Le décane (C10H22) est un composé hydrocarboné comportant dix atomes de carbone disposés en chaîne droite. Il est couramment utilisé comme solvant dans diverses applications industrielles, telles que les processus de nettoyage et de fabrication.
| Nom UICPA | Décane |
| Formule moléculaire | C10H22 |
| Numero CAS | 124-18-5 |
| Synonymes | n-Décane, Hydrure de décyle, n-Amylméthine, Capdécane |
| InChI | InChI=1S/C10H22/c1-3-5-7-9-10-8-6-4-2/h3-10H2,1-2H3 |
Propriétés du décane
Formule décane
La formule du décane est C10H22. Il représente un composé hydrocarboné composé de dix atomes de carbone et de vingt-deux atomes d’hydrogène. La formule montre le nombre exact et le type d’atomes présents dans une molécule de décane.
Décane Masse molaire
La masse molaire de l’hydrure de décyle peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. La masse molaire du carbone (C) est de 12,01 g/mol et la masse molaire de l’hydrogène (H) est de 1,008 g/mol. Par conséquent, la masse molaire de l’hydrure de décyle est d’environ 142,28 g/mol.
Point d’ébullition du décane
Le décane a un point d’ébullition d’environ 174°C (345°F). Cela signifie qu’à pression atmosphérique normale, l’hydrure de décyle commence à se vaporiser et à se transformer en état gazeux à cette température. Le point d’ébullition est une caractéristique importante de l’hydrure de décyle et est utilisé pour déterminer ses propriétés physiques et ses applications.
Décane Point de fusion
Le point de fusion de l’hydrure de décyle est d’environ -29°C (-20°F). Cela signifie la température à laquelle l’hydrure de décyle passe de son état solide à son état liquide. Ce faible point de fusion rend l’hydrure de décyle facilement liquéfiable dans des conditions normales.
Densité du décane g/mL
L’hydrure de décyle a une densité d’environ 0,73 g/mL. La densité est la mesure de la masse par unité de volume. La densité de l’hydrure de décyle indique sa lourdeur ou sa légèreté relative par rapport à un volume égal d’eau. La faible densité de l’hydrure de décyle suggère qu’il est plus léger que l’eau.
Décane Poids moléculaire
Le poids moléculaire de l’hydrure de décyle est d’environ 142,28 g/mol. Il est calculé en additionnant les poids atomiques de tous les atomes d’une molécule d’hydrure de décyle. Le poids moléculaire fournit des informations précieuses sur la taille et la masse de la molécule d’hydrure de décyle.
Structure du décane
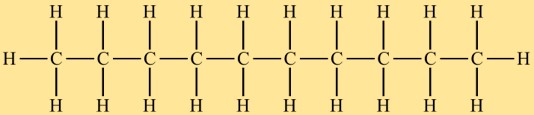
L’hydrure de décyle a une structure à chaîne droite, avec dix atomes de carbone liés entre eux dans un arrangement linéaire. Chaque atome de carbone forme quatre liaisons covalentes simples avec les atomes d’hydrogène environnants. La chaîne carbonée de l’hydrure de décyle n’est pas ramifiée et cette caractéristique structurelle influence ses propriétés chimiques et physiques.
Solubilité du décane
L’hydrure de décyle est insoluble dans l’eau mais soluble dans les solvants non polaires tels que le benzène, l’éther et l’hexane. Sa nature apolaire entrave son interaction avec des substances polaires comme l’eau. La solubilité de l’hydrure de décyle est une considération importante dans divers processus et applications industriels, en particulier lorsqu’il s’agit de solvants non polaires.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,73 |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 142,28 g/mole |
| Densité | 0,73 g/ml |
| Point de fusion | -29°C (-20°F) |
| Point d’ébullition | 174°C (345°F) |
| Point d’éclair | 43°C (109°F) |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les solvants non polaires tels que le benzène, l’éther et l’hexane |
| Pression de vapeur | 1,22 mmHg à 20°C |
| Densité de vapeur | 4,88 (air = 1) |
| pKa | N’est pas applicable |
| pH | Neutre |
Sécurité et dangers du Decane
L’hydrure de décyle présente certaines considérations de sécurité et certains dangers. Il est inflammable et doit être manipulé avec prudence, car il peut s’enflammer lorsqu’il est exposé à des flammes nues ou à des étincelles. La vapeur d’hydrure de décyle est plus lourde que l’air, ce qui signifie qu’elle peut se déplacer sur le sol et s’accumuler dans les zones basses, présentant un risque potentiel d’incendie ou d’explosion. Le contact direct avec l’hydrure de décyle peut provoquer une irritation de la peau et peut également provoquer une irritation des yeux. Il est important d’utiliser des mesures de protection appropriées, telles que des gants et des lunettes, lorsque vous travaillez avec de l’hydrure de décyle. Une ventilation adéquate est cruciale pour minimiser la concentration de vapeurs d’hydrure de décyle dans les espaces clos.
| Symboles de danger | Inflammable |
| Description de la sécurité | – Tenir à l’écart des flammes nues, – Utiliser dans des zones bien ventilées – Porter des gants et des lunettes de protection, – Éviter tout contact direct avec la peau et les yeux |
| Identifiants des Nations Unies | ONU 2247 |
| Code SH | 2901.10.00 |
| Classe de danger | Classe 3 (Liquide inflammable) |
| Groupe d’emballage | GE II |
| Toxicité | Faible toxicité |
Méthodes de synthèse du décane
Il existe plusieurs méthodes pour synthétiser l’hydrure de décyle.
- Une méthode courante de synthèse de l’hydrure de décyle consiste à faire réagir le décène avec de l’hydrogène gazeux en présence d’un catalyseur approprié, tel que le palladium ou le nickel. Ce processus sature les doubles liaisons carbone-carbone du décène, le convertissant en hydrure de décyle.
- Une autre méthode est l’oligomérisation de l’éthylène , où des catalyseurs, généralement des complexes de métaux de transition, combinent des molécules d’éthylène pour former des hydrocarbures de poids moléculaire plus élevé, notamment l’hydrure de décyle.
- Les procédés de raffinage du pétrole produisent également de l’hydrure de décyle. Dans ce processus, la distillation du pétrole brut sépare et purifie une fraction contenant de l’hydrure de décyle et des hydrocarbures similaires pour obtenir de l’hydrure de décyle pur.
- Le procédé Fischer-Tropsch permet la synthèse de l’hydrure de décyle en faisant réagir du monoxyde de carbone et de l’hydrogène sur un catalyseur, généralement un catalyseur à base de fer ou de cobalt, dans des conditions de température et de pression élevées. Ce processus donne un mélange d’hydrocarbures, dont l’hydrure de décyle.
Il est crucial de souligner que ces méthodes de synthèse à l’échelle industrielle nécessitent des équipements et une expertise spécialisés. Le choix de la méthode de synthèse dépend de facteurs tels que la disponibilité des matières premières, la pureté souhaitée et des considérations économiques.
Utilisations du décane
L’hydrure de décyle trouve diverses applications dans différentes industries en raison de ses propriétés et caractéristiques. Certaines utilisations courantes de l’hydrure de décyle comprennent :
- Solvant : L’hydrure de décyle sert de solvant dans les processus industriels, tels que les applications de nettoyage et de dégraissage. Sa capacité à dissoudre diverses substances non polaires le rend utile dans ces processus.
- Carburant : le carburant diesel contient de l’hydrure de décyle comme composant et l’utilise comme composé de référence pour mesurer l’indice de cétane, qui évalue la qualité d’inflammation des carburants diesel. Il contribue aux propriétés de combustion du carburant diesel.
- Intermédiaire chimique : l’hydrure de décyle sert d’élément de base pour la production d’autres produits chimiques. L’hydrure de décyle sert de matière première pour la synthèse de divers composés, notamment des tensioactifs, des lubrifiants et des polymères.
- Agent d’extraction : Les industries pharmaceutiques et alimentaires utilisent l’hydrure de décyle comme agent d’extraction. Il aide à la séparation et à la purification de certains composés et arômes des matières premières.
- Applications de recherche et de laboratoire : La recherche scientifique et les laboratoires utilisent l’hydrure de décyle. Il sert de composé de référence en chromatographie en phase gazeuse et d’étalon à des fins d’étalonnage.
- Formulations cosmétiques : Les produits cosmétiques et de soins personnels incorporent de l’hydrure de décyle dans leurs formulations. Il agit comme agent revitalisant, émollient et régulateur de viscosité dans divers produits de soins de la peau et des cheveux.
- Lubrifiants industriels : les applications industrielles bénéficient de la faible volatilité et du bon pouvoir lubrifiant de l’hydrure de décyle, en l’utilisant comme lubrifiant. Il réduit la friction et l’usure entre les pièces mobiles.
- Étalons d’étalonnage : La chimie analytique utilise l’hydrure de décyle comme étalon d’étalonnage. Il aide à l’étalonnage et à la validation des instruments et techniques d’analyse.
Dans l’ensemble, les propriétés polyvalentes de l’hydrure de décyle le rendent précieux dans diverses industries, allant de la fabrication à la recherche et au développement.
Des questions:
Q : Qu’est-ce qu’un décane ?
R : L’hydrure de décyle est un hydrocarbure de formule moléculaire C10H22, composé de dix atomes de carbone et de vingt-deux atomes d’hydrogène.
Q : La réduction du 1-décyne en décane nécessite combien d’équivalents d’hydrogène gazeux ?
R : La réduction du 1-décyne en hydrure de décyle nécessite deux équivalents d’hydrogène gazeux.
Q : Le décane est-il polaire ?
R : Non, l’hydrure de décyle est non polaire car il est constitué d’atomes de carbone et d’hydrogène liés par des liaisons covalentes non polaires.
Q : L’iode est-il soluble dans C10H22 ?
R : Oui, l’iode est soluble dans le C10H22 (hydrure de décyle) car les deux substances sont apolaires et peuvent se mélanger.
Q : Laquelle des substances suivantes aurait la viscosité la plus élevée ? (a) C4H10 (b) C8H18 (c) C10H22
R : C10H22 (hydrure de décyle) aurait la viscosité la plus élevée parmi les substances données en raison de sa plus grande taille moléculaire et de sa chaîne carbonée plus longue.
Q : Calculez le point de congélation de 23,0 g de décane (C10H22) dans 53,0 g de CHCl3.
R : Le calcul du point de congélation nécessite des informations supplémentaires telles que la constante de dépression du point de congélation pour le solvant (CHCl3) et les fractions molaires des composants pour déterminer la dépression du point de congélation.
