Zinksulfat ist eine Verbindung mit der chemischen Formel ZnSO4. Es wird häufig als Nahrungsergänzungsmittel zur Behandlung von Zinkmangel und als Dünger für Nutzpflanzen verwendet.
| IUPAC-Name | Zinksulfat |
| Molekularformel | ZnSO4 |
| CAS-Nummer | 7733-02-0 |
| Synonyme | Weißes Vitriol, Zinkvitriol, Zink(II)-sulfat, Zink(2+)-sulfat, Zinkmonosulfat, Zinksulfat-Heptahydrat, Zinksulfat-Monohydrat |
| InChI | InChI=1S/2O.H2S.Zn/h2*1H;1H2;/q;;;+2/p-2 |
Zinksulfat-Formel
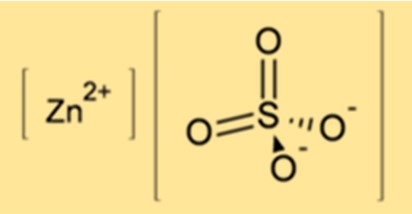
Die chemische Formel für Zinksulfat lautet ZnSO4. Es besteht aus einem Zinkion (Zn2+) und einem Sulfation (SO42-). Die Formel zeigt, dass Zinksulfat ein Zinkatom, ein Schwefelatom und vier Sauerstoffatome enthält.
Molmasse von Zinksulfat
Die Molmasse von Zinksulfat (ZnSO4) beträgt 161,44 g/mol. Sie ist die Summe der Atommassen aller in einem Mol der Verbindung vorhandenen Atome. Zinksulfat besteht aus einem Zinkatom (Zn), einem Schwefelatom (S) und vier Sauerstoffatomen (O). Die Molmasse ist ein wesentlicher Parameter, der bei stöchiometrischen Berechnungen zur Bestimmung der Menge an Reaktanten und Produkten in einer chemischen Reaktion verwendet wird.
Siedepunkt von Zinksulfat
Zinksulfat hat keinen definierten Siedepunkt, da es sich vor Erreichen seines Siedepunkts zersetzt. Die Verbindung zersetzt sich thermisch bei etwa 680 °C und bildet Zinkoxid (ZnO), Schwefeldioxid (SO2) und Sauerstoff (O2). Die Zersetzungstemperatur wird durch das Vorhandensein von Verunreinigungen, den Druck und die Heizrate beeinflusst. Zinksulfat ist bei niedrigen Temperaturen stabil und in Wasser, Methanol und Ethanol löslich.
Schmelzpunkt von Zinksulfat
Der Schmelzpunkt von Zinksulfat hängt vom Hydratationsgrad der Verbindung ab. Zinksulfat-Heptahydrat (ZnSO4.7H2O) hat einen Schmelzpunkt von 100 °C, während Zinksulfat-Monohydrat (ZnSO4.H2O) bei 70 °C schmilzt. Wasserfreies Zinksulfat (ZnSO4) zersetzt sich vor dem Schmelzen. Der Schmelzpunkt wird durch Faktoren wie Druck, Reinheit und Heizrate beeinflusst.
Dichte von Zinksulfat g/ml
Die Dichte von Zinksulfat variiert je nach Hydratationszustand. Zinksulfat-Heptahydrat hat eine Dichte von 1,957 g/cm³, Zinksulfat-Monohydrat hat eine Dichte von 3,08 g/cm³ und wasserfreies Zinksulfat hat eine Dichte von 3,54 g/cm³. Die Dichte ist eine physikalische Eigenschaft, die die Masse pro Volumeneinheit eines Stoffes bestimmt. Die Dichte von Zinksulfat wird auch von Temperatur und Druck beeinflusst.
Molekulargewicht von Zinksulfat
Das Molekulargewicht von Zinksulfat beträgt 161,44 g/mol. Sie wird durch Addition der Atomgewichte von Zink, Schwefel und Sauerstoff berechnet, die jeweils 65,38 g/mol, 32,06 g/mol und 63,998 g/mol betragen. Das Molekulargewicht wird in verschiedenen Berechnungen verwendet, beispielsweise zur Bestimmung der Konzentration von Zinksulfatlösungen in chemischen und biologischen Experimenten.
Struktur von Zinksulfat
Zinksulfat hat in seiner wasserfreien Form eine kristalline Struktur mit abwechselnd angeordneten Zinkkationen (Zn2+) und Sulfatanionen (SO42-). Das Zinkkation wird von sechs Sauerstoffatomen aus sechs Sulfatanionen koordiniert und bildet eine verzerrte oktaedrische Geometrie. In hydratisierter Form bildet Zinksulfat-Heptahydrat monokline Kristalle, während Zinksulfat-Monohydrat orthorhombische Kristalle bildet. Die in den Hydraten enthaltenen Wassermoleküle sind über Wasserstoffbrücken schwach an das Zinksulfatnetzwerk gebunden.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 3,54 g/cm³ (wasserfrei) |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 161,44 g/Mol |
| Dichte | 1,957 g/cm³ (Heptahydrat), 3,08 g/cm³ (Monohydrat), 3,54 g/cm³ (wasserfrei) |
| Fusionspunkt | 70°C (Monohydrat), 100°C (Heptahydrat) |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser, Methanol und Ethanol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | pKa1=1,9, pKa2=3,1, pKa3=9,8 |
| pH-Wert | Der pH-Wert der 0,1 M Lösung beträgt 4,2 |
Sicherheit und Gefahren von Zinksulfat
Bei bestimmungsgemäßer Verwendung ist Zinksulfat im Allgemeinen sicher zu handhaben. Bei Kontakt kann es jedoch zu Reizungen der Augen, der Haut und der Atemwege kommen. Das Verschlucken großer Mengen kann zu Übelkeit, Erbrechen und Durchfall führen. Eine langfristige Exposition gegenüber Zinksulfatstaub kann zu Reizungen der Atemwege oder Metallrauchfieber führen. Beim Umgang mit Zinksulfat ist es wichtig, geeignete persönliche Schutzausrüstung (PSA) wie Handschuhe und Schutzbrille zu tragen. Im Falle einer versehentlichen Exposition die betroffenen Stellen mit reichlich Wasser ausspülen und ggf. einen Arzt konsultieren. Lagern Sie Zinksulfat in einem dicht verschlossenen Behälter und fern von unverträglichen Substanzen.
| Gefahrensymbole | XI |
| Sicherheitsbeschreibung | Außerhalb der Reichweite von Kindern aufbewahren. Schutzhandschuhe/Schutzkleidung/Augenschutz/Gesichtsschutz tragen. BEI KONTAKT MIT DEN AUGEN: Einige Minuten lang vorsichtig mit Wasser spülen. Entfernen Sie Kontaktlinsen, falls vorhanden und einfach möglich. Spülen Sie weiter. BEI VERSCHLUCKEN: Mund ausspülen. KEIN Erbrechen herbeiführen. Bei Unwohlsein ärztlichen Rat einholen/ärztliche Hilfe hinzuziehen. Inhalt/Behälter gemäß den lokalen/regionalen/nationalen/internationalen Vorschriften entsorgen. |
| AN-Kennungen | Nicht reguliert |
| HS-Code | 2833.29.90 |
| Gefahrenklasse | 9 – Verschiedene gefährliche Güter |
| Verpackungsgruppe | III |
| Toxizität | Zinksulfat gilt allgemein als wenig toxisch. Allerdings kann die Einnahme großer Mengen zu Magen-Darm-Reizungen führen und zu Erbrechen, Durchfall und Dehydrierung führen. Das Einatmen von Staub oder Nebel kann zu Reizungen der Atemwege führen. Zinksulfat kann bei Kontakt Augen- und Hautreizungen verursachen. Eine längere Exposition gegenüber hohen Konzentrationen an Zinksulfatstaub kann zu Metallrauchfieber führen. |
Methoden zur Zinksulfat-Synthese
Es gibt verschiedene Methoden zur Synthese von Zinksulfat, abhängig von der gewünschten Reinheit, Partikelgröße und dem Hydratationsgrad des Endprodukts. Eine gängige Methode ist die Reaktion von metallischem Zink oder Zinkoxid mit Schwefelsäure:
1. Zinkmetall + Schwefelsäure → Zinksulfat + Wasserstoffgas
2. Zinkoxid + Schwefelsäure → Zinksulfat + Wasser
Um die Ausbeute und Reinheit von Zinksulfat zu optimieren, muss die Reaktion unter kontrollierten Bedingungen hinsichtlich Temperatur, Rühren und Säurekonzentration durchgeführt werden. Anschließend führen Sie weitere Verarbeitungsschritte wie Kristallisation, Trocknung und Siebung der resultierenden Zinksulfatlösung durch, um die gewünschte Partikelgröße und den gewünschten Hydratationsgrad zu erreichen.
Eine andere Methode zur Herstellung von Zinksulfat beinhaltet die Reaktion von Zinkerz oder -konzentrat mit Schwefelsäure:
3. Zinkerz/-konzentrat + Schwefelsäure → Zinksulfat + Eisensulfat + Wasser
Zinksulfat kann durch Techniken wie Filtration, Fällung oder Lösungsmittelextraktion von Eisensulfat und anderen Verunreinigungen getrennt werden.
Zur Herstellung von Zinksulfat kann Zinkcarbonat oder Zinkhydroxid mit Schwefelsäure umgesetzt oder Zinkasche mit Schwefelsäure oxidiert werden.
Die Wahl der Methode hängt von Faktoren wie der Verfügbarkeit von Rohstoffen, Kosten und Produktspezifikationen ab.
Verwendungsmöglichkeiten von Zinksulfat
Aufgrund seiner einzigartigen Eigenschaften findet Zinksulfat ein breites Anwendungsspektrum in der Industrie, Landwirtschaft und Medizin. Hier sind einige häufige Anwendungen von Zinksulfat:
- Dünger: Wird als Mikronährstoffdünger verwendet, der Pflanzen mit essentiellem Zink für gesundes Wachstum und Entwicklung versorgt.
- Tierfutter: Wird Tierfutter als Nahrungsergänzungsmittel zugesetzt, um Zinkmangel vorzubeugen und die allgemeine Gesundheit zu verbessern.
- Wasseraufbereitung: Wird in Wasseraufbereitungsanlagen verwendet, um Verunreinigungen zu entfernen und Trübungen zu reduzieren.
- Verzinkung: Wird beim Verzinkungsprozess verwendet, bei dem Eisen und Stahl mit einer Zinkschicht überzogen werden, um Korrosion zu verhindern.
- Medizin: Wird medizinisch als Nahrungsergänzungsmittel zur Behandlung von Zinkmangel sowie in topischen Salben zur Behandlung von Hauterkrankungen wie Ekzemen und Akne verwendet.
- Färben: Wird beim Färben und Drucken von Textilien verwendet, um die Farbechtheit und Helligkeit von Farbstoffen zu verbessern.
- Galvanisieren: Wird beim Galvanisieren verwendet, um eine Zinkschicht auf Metalloberflächen zum Korrosionsschutz und zu dekorativen Zwecken abzuscheiden.
- Flammhemmend: Wird als Flammschutzmittel in Kunststoffen, Gummi und anderen Materialien verwendet, um die Brandgefahr zu verringern.
- Weitere Verwendungszwecke: Verwendung bei der Herstellung von Pigmenten, Papier, Seifen und Reinigungsmitteln.
Fragen:
F: Was würden Sie beobachten, wenn einer Eisensulfatlösung Zink zugesetzt wird?
A: Wenn einer Eisensulfatlösung Zink zugesetzt wird, kommt es zu einer Verdrängungsreaktion. Das reaktivere Zink verdrängt das weniger reaktive Eisen aus der Sulfatlösung und bildet Zinksulfat und metallisches Eisen. Die Reaktion kann als Bildung eines rotbraunen Feststoffs und der Freisetzung von Wasserstoffgas beobachtet werden.
F: Was passiert, wenn einer Kupfersulfatlösung ein Stück Zink hinzugefügt wird?
A: Wenn ein Stück metallisches Zink zu einer Kupfersulfatlösung gegeben wird, kommt es zu einer Verdrängungsreaktion. Zink ist reaktiver als Kupfer, daher verdrängt es Kupfer aus der Sulfatlösung und bildet Zinksulfat und einen rotbraunen Feststoff aus metallischem Kupfer. Die Reaktion kann beobachtet werden, wenn die Lösung blau wird, wenn Kupferionen in die Lösung freigesetzt werden und sich ein fester Kupferniederschlag auf der Oberfläche des Zinkmetalls bildet.
F: Ist Zinksulfat ein Salz?
A: Ja, Zinksulfat ist ein Salz, das aus Zinkionen (Zn2+) und Sulfationen (SO42-) besteht. Es ist eine weiße kristalline Verbindung mit der Formel ZnSO4 und wird häufig in verschiedenen Anwendungen wie Düngemitteln, Tierfutter und Medikamenten verwendet.
F: Wo kann man Zinksulfatpulver kaufen?
A: Zinksulfatpulver kann bei Chemielieferanten, Online-Händlern und landwirtschaftlichen Fachgeschäften gekauft werden. Dabei ist darauf zu achten, dass das Produkt hochwertig und für den vorgesehenen Verwendungszweck geeignet ist.
F: Ist Zinksulfat löslich?
A: Ja, Zinksulfat ist in Wasser und Glycerin löslich. Die Löslichkeit von Zinksulfat variiert mit der Temperatur, wobei die Löslichkeit bei höheren Temperaturen höher ist. Die Löslichkeit kann auch durch die Anwesenheit anderer Ionen in der Lösung beeinflusst werden.
F: Wofür wird Zinksulfat verwendet?
A: Zinksulfat hat verschiedene Anwendungen, darunter die Verwendung als Düngemittel, Tierfutterzusatz, Wasseraufbereitungsmittel, Medizin und bei der Herstellung von Pigmenten, Papier und Textilien. Es wird auch beim Galvanisieren, in Flammschutzmitteln und als Nahrungsergänzungsmittel zur Behandlung von Zinkmangel und zur Unterstützung der allgemeinen Gesundheit verwendet.
