Zinkhydroxid (Zn(OH)2) ist eine weiße pulverförmige Substanz, die entsteht, wenn Zink mit Wasser reagiert. Es wird in einer Vielzahl von Anwendungen eingesetzt, unter anderem als Korrosionsinhibitor und in medizinischen Salben.
| IUPAC-Name | Zinkhydroxid |
| Molekularformel | Zn(OH)2 |
| CAS-Nummer | 20427-58-1 |
| Synonyme | Zinkdihydroxid; Zink(II)-hydroxid |
| InChI | InChI=1S/2H2O.Zn/h2*1H2;/q;;+2/p-2 |
Eigenschaften von Zinkhydroxid
Zinkhydroxid-Formel
Die Formel für Zinkdihydroxid lautet Zn(OH)2. Es besteht aus einem Zn2+-Ion, das durch Ionenbindungen mit zwei OH–Ionen verbunden ist. Die Formel besagt, dass jedes Zinkion von zwei Hydroxidgruppen umgeben ist.
Molmasse von Zinkhydroxid
Die Molmasse von Zinkdihydroxid (Zn(OH)2) wird durch Addition der Atommassen seiner Bestandteile berechnet. Zink (Zn) hat eine Molmasse von etwa 65,38 g/mol, während die Molmasse einer OH-Gruppe etwa 17,01 g/mol beträgt. Die Molmasse von Zinkdihydroxid beträgt daher etwa 99,42 g/mol.
Siedepunkt von Zinkhydroxid
Zinkdihydroxid hat keinen eindeutigen Siedepunkt, da es sich vor Erreichen der Siedetemperatur zersetzt. Beim Erhitzen zerfällt es in Zinkoxid (ZnO) und Wasser (H2O). Daher kommt Zinkdihydroxid häufiger in fester Form als in flüssiger Form vor.
Schmelzpunkt von Zinkhydroxid
Zinkdihydroxid hat einen Schmelzpunkt von etwa 125 °C (257 °F). Bei dieser Temperatur geht das feste Zn(OH)2 in den flüssigen Zustand über. Es ist wichtig, beim Erhitzen vorsichtig mit Zinkdihydroxid umzugehen, um seine Zersetzung bei höheren Temperaturen zu vermeiden.
Dichte von Zinkhydroxid g/ml
Die Dichte von Zinkdihydroxid beträgt etwa 3,05 g/ml. Dieser Dichtewert bezieht sich auf die Masse an Zinkdihydroxid pro Volumeneinheit. Die hohe Dichte weist darauf hin, dass Zinkdihydroxid eine relativ schwere Verbindung ist.
Molekulargewicht von Zinkhydroxid
Das Molekulargewicht von Zinkdihydroxid beträgt etwa 99,42 g/mol. Es stellt die Summe der Atomgewichte aller in einem Zn(OH)2-Molekül vorhandenen Atome dar, einschließlich des Zinkatoms und zweier Hydroxidgruppen.
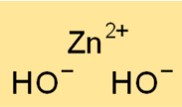
Struktur von Zinkhydroxid
Zinkdihydroxid hat eine kristalline Struktur und liegt überwiegend als weißes, amorphes Pulver vor. Zn2+-Ionen sind von zwei OH–Ionen in tetraedrischer Anordnung umgeben.
Löslichkeit von Zinkhydroxid
Zinkdihydroxid ist in Wasser schlecht löslich, d. h., es löst sich nur begrenzt auf. In wässrigen Lösungen kann es teilweise in Zn2+-Ionen und OH–Ionen dissoziieren. Die Löslichkeit von Zinkdihydroxid wird durch Faktoren wie Temperatur und pH-Wert beeinflusst.
| Aussehen | weißes Puder |
| Spezifisches Gewicht | Unzutreffend |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 99,42 g/Mol |
| Dichte | 3,05 g/ml |
| Fusionspunkt | 125 °C (257 °F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Teilweise löslich, teilweise dissoziiert in Zn2+- und OH–Ionen |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Alkalisch (basisch) |
Sicherheit und Gefahren von Zinkhydroxid
Zinkdihydroxid weist bestimmte Sicherheitsaspekte und Gefahren auf. Beim Umgang mit diesem Stoff ist es unbedingt erforderlich, geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrillen zu tragen, um Haut- und Augenkontakt zu vermeiden. Bei Verschlucken oder Einatmen sofort einen Arzt aufsuchen. Vermeiden Sie hohe Temperaturen, da es zu gefährlichen Produkten zerfällt. Lagern Sie Zinkdihydroxid an einem kühlen, trockenen Ort, entfernt von unverträglichen Materialien. Sorgen Sie außerdem während der Handhabung für ausreichende Belüftung, um die Ansammlung potenziell schädlicher Dämpfe zu verhindern. Befolgen Sie stets die Sicherheitsrichtlinien und -vorschriften, um Risiken zu minimieren und eine sichere Verwendung zu gewährleisten.
| Gefahrensymbole | Nicht klassifiziert |
| Sicherheitsbeschreibung | Tragen Sie PSA; Kontakt mit Haut, Augen und Verschlucken vermeiden; Bei Exposition einen Arzt aufsuchen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 28161000 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Nicht klassifiziert |
| Toxizität | Geringe Toxizität |
Synthesemethoden für Zinkhydroxid
Verschiedene Methoden können Zinkdihydroxid synthetisieren.
Ein üblicher Ansatz beinhaltet die Reaktion zwischen Zinksalzen wie Zinkchlorid oder Zinksulfat und einer starken Base, normalerweise NaOH oder KOH . Die Reaktion verläuft unter Verdrängung von Chlorid- oder Sulfationen durch OH-Ionen, was zur Bildung von Zinkdihydroxid führt.
Eine andere Methode beinhaltet die Ausfällung von Zinkdihydroxid aus einer Zn-Salzlösung unter Verwendung eines Alkalimetall-OH. Fügen Sie nach und nach eine wässrige Lösung von Zn-Salz zu einer Lösung von Natriumhydroxid oder Kaliumhydroxid hinzu. Dadurch bildet sich ein weißer Niederschlag aus Zinkdihydroxid.
Erhalten Sie Zinkdihydroxid durch Elektrolyse einer Zinksulfatlösung. Leiten Sie einen elektrischen Strom durch die Lösung, wodurch Zinkionen zur Kathode wandern und mit Wassermolekülen reagieren, was zur Ablagerung von Zinkdihydroxid auf der Elektrode führt.
Insgesamt können diese Synthesemethoden Zinkdihydroxid für verschiedene industrielle, Forschungs- und medizinische Anwendungen herstellen.
Verwendung von Zinkhydroxid
Aufgrund seiner einzigartigen Eigenschaften findet Zinkdihydroxid zahlreiche Anwendungen in verschiedenen Bereichen. Zu den wichtigsten Einsatzmöglichkeiten gehören:
- Korrosionshemmer: Zinkdihydroxid hemmt die Korrosion von Beschichtungen und Farben, schützt Metalloberflächen vor Oxidation und Beschädigung und verlängert deren Lebensdauer.
- Medizinische Salben: Verschiedene medizinische Salben verwenden Zinkdihydroxid aufgrund seiner antiseptischen und adstringierenden Eigenschaften zur Behandlung von Hauterkrankungen wie Ekzemen und Windeldermatitis.
- Aktiver pharmazeutischer Inhaltsstoff (API): In der pharmazeutischen Industrie enthalten Medikamente zur Linderung von Magenbeschwerden, einschließlich Antazida, Zinkdihydroxid als aktiven pharmazeutischen Inhaltsstoff.
- Wasseraufbereitung: Bei der Wasseraufbereitung wird Zinkdihydroxid als Gerinnungsmittel verwendet, um Verunreinigungen und Schadstoffe aus dem Wasser zu entfernen.
- Gummiindustrie: In der Gummiindustrie wirkt Zinkdihydroxid als Beschleuniger im Vulkanisationsprozess und verbessert dadurch die Festigkeit und Elastizität des Gummis.
- Klebstoffe: Die Formulierung von Klebstoffen und Leimen enthält Zinkdihydroxid, um verbesserte Klebeeigenschaften zu erzielen.
- Farbtrockner: Zinkdihydroxid wirkt als Trockner in Ölfarben und beschleunigt den Trocknungsprozess.
- Landwirtschaft: In der Landwirtschaft setzen Landwirte Zinkdihydroxid als Fungizid ein, um Nutzpflanzen vor verschiedenen Pilzkrankheiten zu schützen.
- Flammschutzmittel: Hersteller integrieren Zinkdihydroxid als flammhemmenden Zusatzstoff in Kunststoffe und Textilien und verringern so deren Entflammbarkeit.
Die vielseitigen Einsatzmöglichkeiten von Zinkdihydroxid machen es zu einer wertvollen Verbindung in vielen Branchen und tragen zur Verbesserung der Produktleistung und -sicherheit bei.
Fragen:
F: Welche der folgenden Substanzen sind Säuren: AgOH, HF, Ni(OH)2, NH4OH, HMnO4, Zn(OH)2?
A: HF (Flusssäure) und HMnO4 (Permangansäure) sind Säuren.
F: Wie hoch ist der pH-Wert einer gesättigten Lösung von Zn(OH)2? Ksp = 1,8 × 10^−14.
A: Der pH-Wert einer gesättigten Lösung von Zn(OH)2 beträgt etwa 7, was neutral ist.
F: Wenn der Zellen-E° -0,762 V beträgt, ermitteln Sie Ksp für Zn(OH)2?
A: Der Ksp für Zn(OH)2 beträgt ungefähr 4,5 × 10^−17.
F: Was ist Zn(OH)2?
A: Zn(OH)2 ist Zinkdihydroxid, eine weiße pulverförmige Substanz, die entsteht, wenn Zink mit Wasser reagiert.
F: Welcher Stoff ist bei der Herstellung von Kunststoffen wichtig? Zinkhydroxid, Ammoniak, Essigsäure, Salpetersäure?
A: Keiner der genannten Stoffe ist für die Herstellung von Kunststoffen essentiell.
F: Ist Zinkhydroxid löslich?
A: Zinkdihydroxid ist in Wasser schlecht löslich.
F: Wie lautet die chemische Formel von Zinkhydroxid?
A: Die chemische Formel für Zinkdihydroxid lautet Zn(OH)2.
F: Was entsteht, wenn Zink mit Natriumhydroxid reagiert?
A: Wenn Zn mit NaOH reagiert, entsteht Zinkdihydroxid (Zn(OH)2).
F: Ist Zinkhydroxid wasserlöslich?
A: Zinkdihydroxid ist in Wasser schlecht löslich.
F: Ist Zinkhydroxid eine starke Base?
A: Zinkdihydroxid ist eine schwache Base.
