Zinkchlorid (ZnCl2) ist eine weiße kristalline Verbindung. Es wird in verschiedenen industriellen Anwendungen wie Lötflussmitteln, chemischer Synthese und Galvanisierung eingesetzt. Es ist sehr gut wasserlöslich.
| IUPAC-Name | Zinkchlorid |
| Molekularformel | ZnCl2 |
| CAS-Nummer | 7646-85-7 |
| Synonyme | Zinkbutter; Zinkdichlorid; Zink(II)-chlorid; Zinkbutter; CI77043 |
| InChI | InChI=1S/2ClH.Zn/h2*1H;/q;;+2/p-2 |
Eigenschaften von Zinkchlorid
Zinkchlorid-Formel
Die chemische Formel für Zinkdichlorid lautet ZnCl2. Es besteht aus einem Zinkatom (Zn) und zwei Chloratomen (Cl). Diese ionische Verbindung bildet einen weißen kristallinen Feststoff mit einer ausgeprägten Struktur.
Molmasse von Zinkchlorid
Die Molmasse von Zinkdichlorid beträgt etwa 136,29 Gramm pro Mol (g/mol). Sie ergibt sich aus der Summe der Atommassen eines Zinkatoms und zweier Chloratome.
Siedepunkt von Zinkchlorid
Zinkdichlorid hat einen relativ hohen Siedepunkt von etwa 732 Grad Celsius (C) oder 1.350 Grad Fahrenheit (F). Bei dieser Temperatur geht es vom flüssigen in den gasförmigen Zustand über.
Schmelzpunkt von Zinkchlorid
Der Schmelzpunkt von Zinkdichlorid liegt bei etwa 290 Grad Celsius (C) oder 554 Grad Fahrenheit (F). Bei dieser Temperatur geht das feste Zinkdichlorid in den flüssigen Zustand über.
Dichte von Zinkchlorid g/ml
Die Dichte von Zinkdichlorid beträgt bei Raumtemperatur etwa 2,91 Gramm pro Milliliter (g/ml). Diese Eigenschaft beschreibt seine Masse pro Volumeneinheit.
Molekulargewicht von Zinkchlorid
Das aus seiner chemischen Formel berechnete Molekulargewicht von Zinkdichlorid beträgt etwa 136,29 g/mol. Dieser Wert stellt die Summe der Atomgewichte seiner Atombestandteile dar.
Struktur von Zinkchlorid
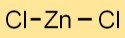
Zinkdichlorid hat eine Kristallgitterstruktur mit Zn2+-Kationen und Clanionen, die durch ionische Bindungen zusammengehalten werden. Die Anordnung bildet ein stabiles und geordnetes dreidimensionales Netzwerk.
Löslichkeit von Zinkchlorid
Zinkdichlorid ist in Wasser sehr gut löslich, was bedeutet, dass es sich in Gegenwart von Wassermolekülen leicht auflöst. Diese Eigenschaft trägt zu seiner weit verbreiteten Verwendung in verschiedenen industriellen Anwendungen und chemischen Prozessen bei.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,91 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 136,29 g/Mol |
| Dichte | 2,91 g/cm³ |
| Fusionspunkt | 290 °C (554 °F) |
| Siedepunkt | 732 °C (1350 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut wasserlöslich |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Alkohol und Aceton |
| Dampfdruck | 1 mmHg bei 359 °C |
| Wasserdampfdichte | 5,4 (Luft = 1) |
| pKa | -1.9 |
| pH-Wert | ~5 (0,1 M Lösung in Wasser) |
Sicherheit und Gefahren von Zinkchlorid
Zinkdichlorid birgt bestimmte Sicherheitsrisiken, die eine sorgfältige Handhabung erfordern. Direkter Kontakt mit der Haut oder den Augen kann zu Reizungen und Verbrennungen führen. Das Einatmen seiner Dämpfe kann zu Reizungen der Atemwege führen. Beim Umgang mit der Masse ist unbedingt Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Darüber hinaus sollte es an einem gut belüfteten Ort und fern von unverträglichen Substanzen gelagert werden. Bei Verschlucken oder versehentlicher Exposition sofort einen Arzt aufsuchen. Vermeiden Sie die Freisetzung in die Umwelt, da es für Wasserlebewesen schädlich sein kann. Durch die Einhaltung geeigneter Sicherheitsmaßnahmen und Richtlinien können die mit Zinkdichlorid verbundenen Risiken wirksam minimiert werden.
| Gefahrensymbole | Ätzend (C); Schädlich (Xn) |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. In einem gut belüfteten Bereich verwenden. Tragen Sie Handschuhe und Schutzbrille. Bei Kontakt oder Verschlucken einen Arzt konsultieren. Nicht in die Umwelt gelangen lassen. Von unverträglichen Substanzen fernhalten. |
| UN-Identifikationsnummern | UN Nr. 2331 (Wasserfreies Zinkdichlorid); UN Nr. 2332 (Zinkdichlorid, Lösung) |
| HS-Code | 28273990 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II (mittlere Gefahr) |
| Toxizität | Gesundheitsschädlich beim Verschlucken oder Einatmen. |
Methoden zur Synthese von Zinkchlorid
Verschiedene Methoden ermöglichen die Synthese von Zinkdichlorid.
Ein gängiger Ansatz beinhaltet die Reaktion von Zinkoxid (ZnO) mit Salzsäure (HCl) . Bei dieser Methode gibt ein Chemiker unter ständigem Rühren langsam ZnO zu einer HCl-Lösung hinzu. Bei der Reaktion entstehen als Nebenprodukte Zinkdichlorid und Wasser. Eine andere Methode besteht darin, Zinkmetall direkt mit Chlorgas (Cl2) zu kombinieren. Diese Reaktion erfordert eine sorgfältige Kontrolle von Temperatur und Druck, um ein erfolgreiches Ergebnis sicherzustellen.
Ein alternativer Prozess besteht darin, das Zinkmetall in einer HCl-Lösung aufzulösen, was zur Bildung von Zinkdichlorid und Wasserstoffgas (H2) führt. Bei der Behandlung von HCl mit Zinkcarbonat (ZnCO3) oder Zinkhydroxid (Zn(OH)2) entstehen als Nebenprodukte Zinkdichlorid, Wasser und Kohlendioxid (CO2).
Zinksulfat (ZnSO4) und Bariumchlorid (BaCl2) durchlaufen eine doppelte Zersetzungsreaktion, um Zinkdichlorid sowie die Bildung von Bariumsulfat (BaSO4) zu ergeben. Durch das Mischen dieser beiden Verbindungen fällt das Zinkdichlorid aus, während das Bariumsulfat (BaSO4) in der Lösung verbleibt.
Jede dieser Methoden bietet einen Weg für die Synthese von Zinkdichlorid und die Wahl der Methode hängt von Faktoren wie der Verfügbarkeit von Reagenzien, Reaktionsbedingungen und der gewünschten Reinheit des Endprodukts ab.
Verwendung von Zinkchlorid
Zinkdichlorid findet aufgrund seiner vielseitigen Eigenschaften ein breites Anwendungsspektrum in verschiedenen Branchen. Hier sind einige wichtige Anwendungen von Zinkdichlorid:
- Verzinken: Zinkdichlorid spielt im Verzinkungsprozess eine wesentliche Rolle, um die Korrosion von Metallen wie Stahl und Eisen zu verhindern. Es bildet eine schützende Zinkschicht, die ihre Langlebigkeit und Haltbarkeit verbessert.
- Lötflussmittel: Bei Lötvorgängen fungiert Zinkdichlorid als Flussmittel, um Metalloxide von der Oberfläche von Metallen zu entfernen und so für eine bessere Haftung und eine starke Bindung zwischen dem Lot und dem Metall zu sorgen.
- Chemische Synthese: Es dient als Katalysator oder Reagens in vielen chemischen Reaktionen, wie z. B. Acylierung und Friedel-Crafts-Dehydratisierung.
- Holzschutz: Holzschutzanwendungen verwenden Zinkdichlorid, um das Holz vor Pilzfäule und Insekten zu schützen und so seine Lebensdauer zu verlängern.
- Textilverarbeitung: In der Textilindustrie erleichtert es die Herstellung merzerisierter Baumwollstoffe und verleiht wünschenswerte Eigenschaften wie erhöhten Glanz und verbesserte Festigkeit.
- Batterieelektrolyt: Zinkdichlorid fungiert in einigen Batterien, wie z. B. der Zink-Kohlenstoff-Batterie, als Elektrolyt und trägt dazu bei, den Ionenfluss zwischen den Elektroden zu erleichtern.
- Deodorant und Antitranspirant: Aufgrund seiner adstringierenden Eigenschaften, die dazu beitragen, die Schweißproduktion zu reduzieren und Körpergeruch zu kontrollieren, ist es ein häufiger Bestandteil von Antitranspirantien.
- Pharmazeutika: Zinkdichlorid findet Anwendung in verschiedenen pharmazeutischen Formulierungen, insbesondere in Mundwässern, Halspastillen und topischen antiseptischen Lösungen.
- Färbereiindustrie: Die Färbereiindustrie verwendet Zinkdichlorid als Beizmittel im Färbeprozess, um die Farbechtheit von Stoffen mit Farbstoffen zu verbessern.
- Klebstoffformulierungen: Hersteller integrieren Zinkdichlorid in Klebstoffformulierungen, um die Klebeeigenschaften von Klebstoffen und Zementen zu verbessern.
Die Vielseitigkeit von Zinkdichlorid macht es zu einer unverzichtbaren Verbindung in vielen industriellen Prozessen und Alltagsprodukten und trägt zum Fortschritt mehrerer Schlüsselindustrien bei.
Fragen:
F: Ist ZnCl2 wasserlöslich?
A: Ja, ZnCl2 ist in Wasser gut löslich.
F: Wie lautet die Nettoionengleichung für die Reaktion von ZnCl2 mit NaOH?
A: Die Nettoionengleichung lautet Zn²⁺(aq) + 2OH⁻(aq) → Zn(OH)₂(s).
F: Ist ZnCl2 löslich?
A: Ja, ZnCl2 ist wasserlöslich.
F: Ist ZnCl2 ionisch oder molekular?
A: ZnCl2 ist eine ionische Verbindung.
F: Welche Art von Bindung kommt in Zink(II)-chlorid, ZnCl2, vor?
A: Ionenbindung findet in ZnCl2 statt.
F: Welche Änderung könnte die Geschwindigkeit der ZnCl2-Produktion verringern?
A: Eine Senkung der Reaktionstemperatur könnte die ZnCl2-Produktionsrate verringern.
F: Ist ZnCl2 fest?
A: Ja, ZnCl2 ist bei Raumtemperatur ein Feststoff.
F: Ist ZnCl2 ein Salz?
A: Ja, ZnCl2 gilt als Salz.
F: Wie erhält man Zinkchlorid aus Zink?
A: Durch die Reaktion von Zink mit Salzsäure entsteht Zinkchlorid.
F: Wie lautet die Formel für Zinkchlorid?
A: Die Formel für Zinkchlorid lautet ZnCl2.
F: Sind Zinkchloridbatterien schädlich für die Erde?
A: Ja, Zinkchloridbatterien können schädlich für die Umwelt sein, wenn sie nicht ordnungsgemäß entsorgt werden.
F: Wie groß ist die Molmasse von Zinkchlorid?
A: Die Molmasse von Zinkchlorid beträgt etwa 136,29 g/mol.
