Zinkcarbonat (ZnCO3) ist ein weißer, geruchloser Feststoff, der durch die Reaktion von Zink mit Carbonationen entsteht. Aufgrund seiner einzigartigen Eigenschaften wird es in verschiedenen Anwendungen wie Keramik und Pharmazeutika eingesetzt.
| IUPAC-Name | Zinkcarbonat |
| Molekularformel | ZnCO3 |
| CAS-Nummer | 3486-35-9 |
| Synonyme | Zink(II)carbonat; Smithsonit; Kohlensäurehaltiges Zink; Zinkcarbonat |
| InChI | InChI=1S/CH2O3.Zn/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Eigenschaften von Zinkcarbonat
Zinkcarbonat-Formel
Die chemische Formel für Zinkcarbonat lautet ZnCO3. Es besteht aus einem Zinkatom (Zn), einem Kohlenstoffatom (C) und drei Sauerstoffatomen (O). Diese Verbindung ist ein weißer, geruchloser Feststoff und kommt in der Natur häufig als Mineral Smithsonit vor.
Molmasse von Zinkcarbonat
Die Molmasse von Zinkcarbonat kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Zink hat eine Molmasse von etwa 65,38 g/mol, Kohlenstoff von 12,01 g/mol und Sauerstoff von etwa 16,00 g/mol. Somit beträgt die Molmasse von Zinkcarbonat etwa 125,38 g/mol.
Siedepunkt von Zinkcarbonat
Zinkcarbonat hat keinen eindeutigen Siedepunkt, da es sich beim Erhitzen zersetzt, Kohlendioxid freisetzt und Zinkoxid (ZnO) zurücklässt. Es ist jedoch bis zu Temperaturen um 300 °C stabil.
Schmelzpunkt von Zinkcarbonat
Der Schmelzpunkt von Zinkcarbonat liegt bei etwa 333 °C. Bei dieser Temperatur zersetzen sich Zinkcarbonate thermisch und bilden Zinkoxid und Kohlendioxid.
Dichte von Zinkcarbonat g/ml
Die Dichte von Zinkcarbonat beträgt etwa 4,398 g/ml. Dieser Wert weist darauf hin, dass Zinkcarbonat im Vergleich zu vielen anderen Verbindungen ein relativ dichter Feststoff ist.
Molekulargewicht von Zinkcarbonat
Das Molekulargewicht von Zinkcarbonat, auch Molmasse genannt, beträgt etwa 125,38 g/mol. Es ist die Masse eines Mols Zinkcarbonatmoleküle und wird in verschiedenen chemischen Berechnungen verwendet.
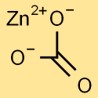
Struktur von Zinkcarbonat
Zinkcarbonat hat eine trigonale Kristallstruktur. Das Zinkkation (Zn2+) ist von Carbonatanionen (CO32-) in einer trigonal-planaren Anordnung umgeben. Diese Anordnung verleiht Zinkcarbonat seine einzigartigen physikalischen und chemischen Eigenschaften.
Löslichkeit von Zinkcarbonat
Zinkcarbonat ist in Wasser schlecht löslich. Seine Löslichkeit nimmt mit sinkender Temperatur und steigendem pH-Wert ab. Aufgrund der Bildung löslicher Zinksalze kann es sich auch in sauren Lösungen lösen. In Gegenwart von Carbonaten oder Hydroxiden bildet es jedoch unlösliche Niederschläge.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 4.398 g/ml (ungefähr) |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 125,38 g/Mol |
| Dichte | 4.398 g/ml (ungefähr) |
| Fusionspunkt | 333°C (ungefähr) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | In den meisten Lösungsmitteln unlöslich, kann sich auch in sauren Lösungen lösen |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Leicht alkalisch (ca. 8-9) |
Sicherheit und Gefahren von Zinkcarbonat
Zinkcarbonat birgt bestimmte Sicherheitsrisiken, die besondere Aufmerksamkeit erfordern. Bei Kontakt oder Einatmen kann es zu Reizungen der Haut, der Augen und der Atemwege kommen. Vermeiden Sie die Einnahme, da dies zu Magen-Darm-Beschwerden führen kann. Tragen Sie bei der Handhabung geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille, um direkten Kontakt zu vermeiden. Lagern Sie Zinkcarbonat an einem kühlen, trockenen Ort, entfernt von unverträglichen Substanzen. Bei Verschlucken oder versehentlicher Exposition sofort einen Arzt aufsuchen. Befolgen Sie außerdem die ordnungsgemäßen Abfallentsorgungsverfahren für diese Verbindung, um die Auswirkungen auf die Umwelt zu minimieren. Um die sichere Verwendung von Zinkcarbonat in verschiedenen Anwendungen zu gewährleisten, sind ordnungsgemäße Handhabungs- und Lagerungspraktiken unerlässlich.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Gesundheitsschädlich beim Verschlucken oder Einatmen. Reizt Haut und Augen. Kontakt vermeiden. Bei ausreichender Belüftung verwenden. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 28369900 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe bis mäßige Toxizität |
Methoden zur Zinkcarbonat-Synthese
Zinkcarbonat kann auf verschiedene Weise synthetisiert werden. Ein gängiger Ansatz besteht darin , Zinkoxid (ZnO) mit Kohlendioxid (CO2) in Gegenwart von Wasser oder einem geeigneten Lösungsmittel umzusetzen. Die Reaktion kann bei kontrollierter Temperatur und kontrolliertem Druck durchgeführt werden, um die Bildung von Zinkcarbonat zu fördern.
Eine andere Methode beinhaltet die Reaktion von Zinkchlorid (ZnCl2) oder Zinksulfat (ZnSO4) mit Natriumcarbonat (Na2CO3) oder Kaliumcarbonat (K2CO3) in einer wässrigen Lösung. Bei diesem Prozess entsteht Zinkcarbonat als Niederschlag, der abgetrennt und gesammelt werden kann.
Darüber hinaus kann Zinkcarbonat durch Karbonisierung von Zinkhydroxid (Zn(OH)2) oder Zinkoxid mit Kohlendioxid, entweder in gasförmiger Form oder gelöst in Wasser, gewonnen werden.
In industriellen Umgebungen entsteht Zinkcarbonat häufig als Nebenprodukt der Zinkverarbeitung oder als Ergebnis von Reaktionen mit zinkhaltigen Materialien.
Um ein reines und qualitativ hochwertiges Produkt zu erhalten, ist es wichtig, während der Synthese die richtige Stöchiometrie und die richtigen Reaktionsbedingungen sicherzustellen. Die Wahl der Methode hängt von Faktoren wie der Verfügbarkeit der Reagenzien, der gewünschten Reinheit des Produkts und der beabsichtigten Anwendung des Zinkcarbonats ab.
Verwendung von Zinkcarbonat
Aufgrund seiner einzigartigen Eigenschaften findet Zinkcarbonat vielfältige Anwendungen in verschiedenen Branchen. Hier sind einige bemerkenswerte Verwendungszwecke:
- Keramik: Zinkcarbonat senkt aktiv den Schmelzpunkt von Materialien und verbessert deren Glanz und Transparenz, wenn es als Flussmittel in Keramikglasuren verwendet wird.
- Pharmazeutika: In medizinischen Anwendungen dient Zinkcarbonat als Wirkstoff in einigen antiseptischen und adstringierenden Formulierungen.
- Farben: Zinkcarbonat fungiert aktiv als Weißpigment in Farben und Beschichtungen und sorgt für Glanz und hervorragende Deckkraft.
- Gummiindustrie: Beim Vulkanisationsprozess wirkt Zinkcarbonat als Beschleuniger und verbessert aktiv die mechanischen Eigenschaften von Gummiprodukten.
- Textilindustrie: Als Beizmittel verbessert Zinkcarbonat aktiv die Retention von Farbstoffen auf Stoffen während des Färbeprozesses.
- Elektronik: Zinkcarbonat findet aufgrund seiner elektrischen Eigenschaften aktive Anwendung in elektronischen Bauteilen und als Beschichtungsmaterial für Halbleiter.
- Landwirtschaft: Zinkcarbonat wirkt aktiv als Fungizid und Schimmelschutz für Nutzpflanzen.
- Glasherstellung: Bei der Glasherstellung fungiert Zinkcarbonat als Flussmittel, das den Schmelzpunkt des Glases aktiv senkt und seine Klarheit verbessert.
- Tierfutterzusatz: Hersteller fügen Tierfutter aktiv Zinkcarbonat als wichtige Quelle für essentielles Zink hinzu, das die allgemeine Gesundheit von Nutztieren aktiv unterstützt.
- Wasseraufbereitung: Wasseraufbereitungsanlagen nutzen in ihren Prozessen aktiv Zinkcarbonat, um den pH-Wert aktiv zu kontrollieren und Schwermetallverunreinigungen aktiv zu entfernen.
Die Vielseitigkeit von Zinkcarbonat in verschiedenen Branchen unterstreicht seine Bedeutung als wertvolle Verbindung mit einem breiten Spektrum praktischer Anwendungen.
Fragen:
F: Ist ZnCO3 wasserlöslich?
A: Zinkcarbonat ist in Wasser schlecht löslich.
F: Welche Reaktion tritt am wahrscheinlichsten auf? Pt + FeCl3 Mn + CaO Li + ZnCO3 Cu + 2KNO3
A: Die wahrscheinlichste Reaktion ist Li + ZnCO3.
F: Welche Masse von ZnCO3 enthält 3,11×10^22 O-Atome?
A: Die Masse von ZnCO3 mit 3,11×10^22 O-Atomen kann basierend auf der Molmasse und der Stöchiometrie der Verbindung berechnet werden.
F: Wie heißt ZnCO3?
A: Der Name von ZnCO3 ist Zinkcarbonat.
F: Welche der folgenden Verbindungen ist wasserlöslich? Cu3(PO4)2, CoS, Pb(NO3)2, ZnCO3?
A: ZnCO3 ist in Wasser schlecht löslich.
F: Welche Art von Bindung entsteht zwischen ZnCO3?
A: Zwischen ZnCO3 bilden sich ionische Bindungen.
F: Ist Zinkcarbonat wasserlöslich?
A: Zinkcarbonat ist in Wasser schlecht löslich.
F: Was ist eine Kohlenstoff-Zink-Batterie?
A: Eine Kohlenstoff-Zink-Batterie ist eine Art Trockenbatterie, die eine Zinkanode und eine Kohlenstoffkathode mit einer Elektrolytpaste verwendet.
F: Wie unterscheidet sich eine Alkalibatterie von einer Zink-Kohlenstoff-Trockenzelle?
A: Alkalibatterien haben aufgrund der Verwendung eines alkalischen Elektrolyten eine höhere Energiedichte und eine längere Lebensdauer als Zink-Kohlenstoff-Trockenzellen.
F: Was ist der Unterschied zwischen Kohlenstoff-Zink- und Alkalibatterien?
A: Kohlenstoff-Zink-Batterien haben aufgrund von Unterschieden im Elektrolyt und in der Konstruktion eine geringere Energiekapazität und eine kürzere Lebensdauer als Alkalibatterien.
F: Können Sie Kohlenstoff-Zink-Batterien anstelle von Alkalibatterien verwenden?
A: Ja, aber Kohlenstoff-Zink-Batterien haben möglicherweise eine kürzere Lebensdauer und sind für Geräte mit hohem Stromverbrauch weniger geeignet als Alkalibatterien.
