Zinkacetat (Zn(C2H3O2)2) ist eine chemische Verbindung. Seine Einsatzmöglichkeiten sind in der Industrie und im Labor vielfältig. Es ist wasserlöslich und kann weiße Kristallstrukturen bilden.
| IUPAC-Name | Zinkacetat |
| Molekularformel | Zn(C2H3O2)2 |
| CAS-Nummer | 557-34-6 |
| Synonyme | Zinkdiacetat, Zinkethanoat, Zinksalz der Essigsäure |
| InChI | InChI=1S/2C2H4O2.Zn/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschaften von Zinkacetat
Zinkacetat-Formel
Die chemische Formel für Zinkethanoat lautet Zn(C2H3O2)2. Es besteht aus einem Zinkion (Zn) und zwei Acetationen (C2H3O2). Die Formel gibt das Verhältnis der in der Verbindung vorhandenen Atome an.
Molmasse von Zinkacetat
Die Molmasse von Zinkethanoat kann durch Addition der Atommassen jedes Elements in der Formel berechnet werden. Für Zink (Zn) beträgt die Atommasse 65,38 g/mol und für Acetat (C2H3O2) 59,05 g/mol. Die Molmasse von Zinkethanoat beträgt also etwa 183,39 g/mol.
Siedepunkt von Zinkacetat
Zinkethanoat hat keinen eindeutigen Siedepunkt, da es beim Erhitzen dazu neigt, sich zu zersetzen und Essigsäure zu verlieren. Stattdessen zerfällt es bei hohen Temperaturen in Zinkoxid und Essigsäure.
Schmelzpunkt von Zinkacetat
Zinkethanoat hat einen Schmelzpunkt von etwa 237 °C (459 °F). Bei dieser Temperatur geht die feste Verbindung in den flüssigen Zustand über. Der Schmelzpunkt ist ein wichtiges Merkmal zur Identifizierung.
Dichte von Zinkacetat g/ml
Die Dichte von Zinkethanoat beträgt etwa 1,84 g/ml. Die Dichte ist das Maß für die Masse pro Volumeneinheit eines Stoffes. Die Dichte von Zinkethanoat ist relativ hoch, was auf seine Kompaktheit hinweist.
Molekulargewicht von Zinkacetat
Das Molekulargewicht von Zinkethanoat beträgt 183,39 g/mol. Es ist die Summe der Atomgewichte aller Atome in der Verbindung. Das Molekulargewicht ist für verschiedene chemische Berechnungen und Reaktionen von entscheidender Bedeutung.
Struktur aus Zinkacetat
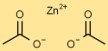
Zinkethanoat hat eine einfache Struktur mit dem Zinkion (Zn) in seinem Zentrum, umgeben von zwei Acetationen (C2H3O2). Acetationen bilden mit dem Zinkion koordinierte kovalente Bindungen.
Löslichkeit von Zinkacetat
Zinkethanoat ist in Wasser und anderen polaren Lösungsmitteln löslich. Die Löslichkeit in Wasser ist relativ hoch und es entsteht eine farblose Lösung. Die Löslichkeit der Verbindung ist für ihre vielfältigen Anwendungen in Industrie und Labor von entscheidender Bedeutung.
| Eigentum | Wert |
| Aussehen | Weiße Kristalle |
| Spezifisches Gewicht | 1,84 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 183,39 g/Mol |
| Dichte | 1,84 g/cm³ |
| Fusionspunkt | 237 °C (459 °F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser und anderen polaren Lösungsmitteln |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Neutral (7) |
Sicherheit und Gefahren von Zinkacetat
Zinkethanoat birgt bei korrekter Handhabung nur minimale Sicherheitsrisiken. Dies kann zu leichten Reizungen der Haut und Augen führen. Vermeiden Sie das Einatmen oder Verschlucken, da dies zu Atemwegs- und Magen-Darm-Beschwerden führen kann. An einem kühlen, trockenen Ort fern von unverträglichen Substanzen lagern. Tragen Sie bei der Handhabung geeignete Schutzausrüstung. Bei Kontakt die betroffenen Stellen mit reichlich Wasser abspülen. Bei anhaltender Reizung einen Arzt konsultieren. Befolgen Sie gute Laborpraktiken und Sicherheitsanweisungen, um Unfälle zu vermeiden. Obwohl es im Allgemeinen sicher ist, sind ein verantwortungsvoller Umgang und Vorsichtsmaßnahmen unerlässlich, um eine sichere Arbeitsumgebung zu gewährleisten.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Verursacht leichte Hautreizungen, Verursacht Augenreizungen, Einatmen/Verschlucken vermeiden. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 29152900 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität |
Methoden zur Zinkacetat-Synthese
Es gibt verschiedene Methoden zur Synthese von Zinkethanoat. Ein gängiger Ansatz beinhaltet die Reaktion zwischen Zinkoxid (ZnO) und Essigsäure (CH3COOH) . Die beiden Stoffe werden vermischt und die Reaktion findet bei hoher Temperatur statt. Während des Prozesses reagiert Zinkoxid mit Essigsäure, was zur Bildung von Zinkethanoat und Wasser führt.
Eine andere Methode beinhaltet die Reaktion von metallischem Zink mit Essigsäure . Wird Essigsäure mit metallischem Zink versetzt, kommt es zu einer Reaktion, bei der Zinkethanoat und Wasserstoffgas entstehen.
Alternativ kann Zinkethanoat durch Reaktion von Zinkcarbonat (ZnCO3) mit Essigsäure hergestellt werden. Zinkcarbonat reagiert mit Essigsäure unter Bildung von Zinkethanoat, Kohlendioxid und Wasser.
Darüber hinaus kann Zinkethanoat durch Behandlung von Zinkhydroxid (Zn(OH)2) mit Essigsäure gewonnen werden. Die Reaktion zwischen diesen Substanzen ergibt Zinkethanoat und Wasser.
Unabhängig von der verwendeten Methode kann das resultierende Zinkethanoat durch Kristallisations- oder Filtrationsprozesse weiter gereinigt werden. Bei der Synthese muss darauf geachtet werden, die Sicherheit zu gewährleisten und ein qualitativ hochwertiges Produkt zu erhalten.
Verwendung von Zinkacetat
Zinkethanoat findet aufgrund seiner vielseitigen Eigenschaften ein breites Anwendungsspektrum in verschiedenen Branchen. Zu den häufigsten Verwendungszwecken gehören:
- Pharmazeutische Industrie: Zinkethanoat trägt aktiv zur Immunfunktion und Wundheilung bei, da Pharmaunternehmen es in verschiedene Medikamente und Nahrungsergänzungsmittel integrieren, um eine Zinkquelle bereitzustellen.
- Textilindustrie: In der Textilindustrie wird es als Beizmittel in Färbeprozessen verwendet, um Textilfarben auf Stoffen zu fixieren und deren Farbechtheit zu verbessern.
- Chemische Synthese: Zinkethanoat fungiert als Katalysator bei organischen Reaktionen und erleichtert Veresterungs- und Acetylierungsprozesse.
- Holzschutz: Holzbehandlungsformulierungen verwenden Zinkethanoat zum Schutz vor Pilz- und Termitenbefall und verlängern so die Lebensdauer von Holzprodukten.
- Verzinken: Beim Verzinken dient Zinkethanoat als Vorprodukt bei der Herstellung von Zinkbeschichtungen und verleiht Stahl und anderen Metallen Korrosionsbeständigkeit.
- Laboranwendungen: Forscher und Wissenschaftler verwenden Zinkethanoat als Reagenz in verschiedenen Laborexperimenten und Analyseverfahren.
- Hautpflegeprodukte: Salben und Cremes enthalten Zinkethanoat wegen seiner adstringierenden und beruhigenden Eigenschaften, die bei Hauterkrankungen wie Akne hilfreich sind.
- Enteisungsmittel: Einige Gebiete verwenden im Winter Zinkethanoat als umweltfreundliches Enteisungsmittel auf Straßen und Gehwegen, um die Eisbildung zu verhindern.
- Gasentschwefelung: Zinkethanoat findet Anwendung in Gasreinigungsprozessen zur Entfernung von Schwefelverbindungen aus Industrieabgasen.
- Lebensmittelindustrie: In der Lebensmittelindustrie fungiert Zinkethanoat als Lebensmittelzusatzstoff und dient in einigen verarbeiteten Lebensmitteln als Säureregulator und Stabilisator.
Insgesamt belegen die verschiedenen Anwendungen von Zinkethanoat seine Bedeutung in mehreren Branchen und machen es zu einer wertvollen Verbindung in verschiedenen Herstellungs- und Forschungsprozessen.
Fragen:
F: Welcher Stoff ist bei der Herstellung von Kunststoffen wichtig?
A: Essigsäure ist bei der Herstellung von Kunststoffen unerlässlich, da sie häufig als Rohstoff für die Herstellung verschiedener synthetischer Polymere verwendet wird.
F: Was ist Zinkacetat?
A: Zinkethanoat ist eine chemische Verbindung, die durch die Reaktion von Zinkoxid oder Zinkmetall mit Essigsäure entsteht und einen weißen kristallinen Feststoff ergibt.
F: Wie lautet die Formel von Zinkacetat?
A: Die Formel für Zinkethanoat lautet Zn(C2H3O2)2.
F: Ist Zinkacetat löslich?
A: Ja, Zinkethanoat ist in Wasser und anderen polaren Lösungsmitteln löslich.
F: Sind Zinkacetat und Zinkgluconat Antikoagulanzien?
A: Nein, Zinkethanoat und Zinkgluconat sind keine Blutverdünner. Dies sind Formen von Zink, die als Nahrungsergänzungsmittel verwendet werden.
F: Ist Zinkessigsäure ein Feststoff?
A: Zinkessigsäure ist keine spezifische Verbindung. Es kann sich auf das Reaktionsprodukt von Zink mit Essigsäure beziehen, bei dem es sich um eine feste Zinkverbindung handelt.
F: Welches Element und welche Verbindung haben die gleiche chemische Reaktion wie Zink und Essigsäure?
A: Das Element ist Zink (Zn) und die Verbindung ist Zinkoxid (ZnO), das auf die gleiche Weise reagiert wie Zink und Essigsäure.
F: Wie sieht die ausgewogene Gleichung für Zink und Essigsäure aus?
A: Die ausgeglichene Gleichung lautet: Zn + 2CH3COOH → Zn(CH3COO)2 + H2.
F: Welche Wirkung hat Zinkacetat auf die Haut?
A: Zinkethanoat wird wegen seiner adstringierenden Eigenschaften in Hautpflegeprodukten verwendet und hilft, Hauterkrankungen wie Akne zu lindern und zu lindern.
