Titanoxid, auch Titandioxid genannt, ist ein natürliches Weißpigment, das häufig in Farben, Beschichtungen, Kunststoffen und Sonnenschutzmitteln verwendet wird. Es hat einen hohen Brechungsindex und eine hohe Opazität.
| IUPAC-Name | Titan(IV)oxid |
| Molekularformel | TiO2 |
| CAS-Nummer | 13463-67-7 |
| Synonyme | Titandioxid, Titan, Anatas, Brookit, Rutil, oktaedrisches Molekularsieb (OMS), E171 |
| InChI | InChI=1S/2O.Ti |
| InChIKey=ZQIUJXQCIJLZJK-UHFFFAOYSA-N |
Eigenschaften von Titandioxid
Molmasse von Titanoxid
Die Molmasse von Titanoxid (TiO2) beträgt etwa 79,87 g/mol. Es ist ein weißes, geruch- und geschmackloses Pulver, unlöslich in Wasser und organischen Lösungsmitteln. Die Molmasse wird berechnet, indem die Atommassen eines Titanatoms und zweier Sauerstoffatome addiert werden, aus denen ein einzelnes TiO2-Molekül besteht. Dieser Wert ist wichtig für die Bestimmung der Stöchiometrie chemischer Reaktionen mit Titanoxid.
Siedepunkt von Titanoxid
Titanoxid hat keinen genau definierten Siedepunkt, da es sich zersetzt, bevor es seinen Schmelzpunkt erreicht. Die Zersetzungstemperatur von TiO2 hängt von der Kristallstruktur, der Partikelgröße und der Reinheit des Materials ab. Beispielsweise zersetzt sich Rutil-TiO2 bei etwa 1850 °C, während sich Anatas-TiO2 bei einer niedrigeren Temperatur, etwa 1600 °C, zersetzt. Bei höheren Temperaturen wird Titanoxid zu metallischem Titan reduziert. Diese Eigenschaft macht es zu einem nützlichen Material für Hochtemperaturanwendungen, beispielsweise für Ofenauskleidungen und feuerfeste Steine.
Schmelzpunkt von Titanoxid
Der Schmelzpunkt von Titanoxid hängt von seiner Kristallstruktur ab. Anatas-TiO2 hat einen Schmelzpunkt von etwa 1550 °C, während Rutil-TiO2 einen höheren Schmelzpunkt von etwa 1850 °C hat. Der Schmelzpunkt von TiO2 wird auch durch im Material vorhandene Verunreinigungen wie Eisen und andere Übergangsmetalle beeinflusst, die den Schmelzpunkt senken und die Kristallstruktur verändern können. Bei hohen Temperaturen kann Titanoxid zu Titanmetall reduziert werden.
Dichte von Titanoxid g/ml
Die Dichte von Titanoxid hängt von der Kristallstruktur und der Partikelgröße ab. Anatas-TiO2 hat eine Dichte von 3,78 g/cm3, während Rutil-TiO2 eine höhere Dichte von 4,23 g/cm3 aufweist. Im Material vorhandene Verunreinigungen beeinflussen die Kristallstruktur von TiO2 und können die Packungsdichte seiner Partikel und damit die Dichte verändern. Im Vergleich zu anderen Metalloxiden weist Titanoxid eine geringe Dichte auf, was es zu einem nützlichen Material für Anwendungen macht, bei denen ein niedriges Gewicht-zu-Volumen-Verhältnis erwünscht ist.
Molekulargewicht von Titanoxid
Das Molekulargewicht von Titanoxid (TiO2) beträgt etwa 79,87 g/mol. Es ist eine Verbindung, die aus einem Titanatom und zwei Sauerstoffatomen besteht. Das Molekulargewicht ist wichtig für die Bestimmung der Stöchiometrie chemischer Reaktionen, an denen Titanoxid beteiligt ist, sowie für seine physikalischen und chemischen Eigenschaften.
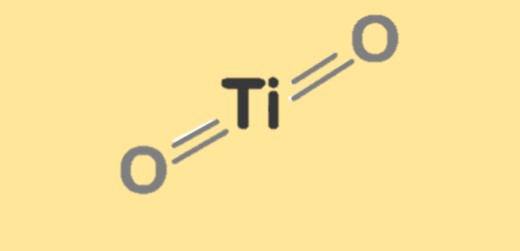
Struktur von Titandioxid
Titandioxid hat drei Hauptkristallstrukturen: Rutil, Anatas und Brookit. Rutil ist am stabilsten und hat eine tetragonale Kristallstruktur, während Anatas eine offenere und verzerrte tetragonale Struktur aufweist. Brookit hat eine orthorhombische Kristallstruktur. Die Kristallstruktur von Titandioxid beeinflusst seine physikalischen und chemischen Eigenschaften wie Dichte, Schmelzpunkt und Reaktivität. Die Struktur von Titandioxid kann durch Dotierung mit anderen Metallen oder durch Änderung der Synthesebedingungen verändert werden, was zu Materialien mit einzigartigen Eigenschaften und Anwendungen führt.
Titandioxid-Formel
Die chemische Formel für Titandioxid lautet TiO2, was bedeutet, dass jedes TiO2-Molekül ein Titanatom und zwei Sauerstoffatome enthält. Die Formel ist wichtig für die Bestimmung der Stöchiometrie chemischer Reaktionen mit Titandioxid sowie seiner physikalischen und chemischen Eigenschaften. Die Formel kann auch zur Berechnung der Menge an Titandioxid verwendet werden, die in einer bestimmten Anwendung benötigt wird, beispielsweise bei der Herstellung von Pigmenten, Beschichtungen und Keramik.
| Aussehen | weißes Puder |
| Spezifisches Gewicht | 3,9 – 4,25 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 79,87 g/Mol |
| Dichte | 3,78 – 4,23 g/cm3 |
| Fusionspunkt | 1550°C (Anatas) – 1850°C (Rutil) |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Unlöslich in Wasser und organischen Lösungsmitteln |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | 6,5 – 8,5 |
Ist Titandioxid sicher?
Titandioxid gilt allgemein als sicher und ungiftig. Es ist nicht brennbar, explosiv und reagiert nicht mit anderen Chemikalien. Allerdings kann es, wie jeder Feinstaub, bei Einatmen in hohen Konzentrationen die Atemwege reizen, was zu Husten, Engegefühl in der Brust und Kurzatmigkeit führen kann. Auch eine längere Exposition gegenüber hohen Staubmengen kann zu Lungenschäden führen. Es ist wichtig, mit Titandioxid in einem gut belüfteten Bereich umzugehen und beim Umgang mit großen Mengen geeignete persönliche Schutzausrüstung, wie z. B. eine Staubmaske, zu tragen. Darüber hinaus sollte eine versehentliche Einnahme oder ein Augenkontakt mit Titandioxid vermieden werden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Wird unter normalen Einsatzbedingungen nicht als gefährlich angesehen |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 28230000 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Gilt im Allgemeinen als ungiftig, kann jedoch bei Einatmen in hohen Konzentrationen die Atemwege reizen. |
Methoden zur Synthese von Titanoxid
Titanoxid kann auf verschiedene Weise synthetisiert werden, darunter chemische und physikalische Verfahren. Die gängigsten Methoden sind:
- Beim Sulfatverfahren reagieren Titanerze mit Schwefelsäure zu einer hydratisierten Form von Titandioxid, das bei hohen Temperaturen kalziniert wird, um das Endprodukt zu erhalten.
- Beim Chloridprozess werden Titanerze mit Chlorgas zu Titantetrachlorid umgesetzt, das dann einer Hydrolyse unterzogen wird, um Titandioxid zu erhalten.
- Bei der Sol-Gel-Methode folgt auf die Hydrolyse von Titanalkoxiden in Lösung eine Kondensationsreaktion, bei der ein Gel entsteht. Anschließend wird das Gel getrocknet und kalziniert, um Titanoxid herzustellen.
- Der Flammensyntheseprozess erzeugt Titanoxidpartikel, indem ein Brennstoff und ein Oxidationsmittel in einer Flamme verbrannt werden, um einen Gasstrom mit hoher Temperatur zu erzeugen. Der Titanvorläufer wird in die Flamme injiziert, wo er reagiert und die Partikel bildet.
- Bei der hydrothermischen Synthesemethode wird ein Titanvorläufer in einer wässrigen Lösung bei hoher Temperatur und hohem Druck gelöst, was das Wachstum von Titanoxidkristallen fördert.
Die Wahl der Methode hängt von den gewünschten Eigenschaften des Titanoxidprodukts sowie den Kosten und der Durchführbarkeit des Verfahrens ab. Jede Methode hat ihre eigenen Vorteile und Grenzen, und Forscher erforschen weiterhin neue Methoden zur Synthese von Titanoxid mit verbesserten Eigenschaften und Leistung.
Wofür wird Titandioxid verwendet?
Titanoxid hat aufgrund seiner einzigartigen Eigenschaften, einschließlich seines hohen Brechungsindex, seiner hohen Opazität und seiner hervorragenden UV-Beständigkeit, ein breites Anwendungsspektrum. Einige der häufigsten Anwendungen von Titanoxid sind:
- Die Pigmentindustrie verwendet Titandioxid in großem Umfang in Farben, Beschichtungen, Kunststoffen und Papier, da es eine hohe Opazität, Helligkeit und UV-Beständigkeit bietet, was es zu einer beliebten Wahl für Außenanwendungen macht.
- Hersteller verwenden Titandioxid häufig in Sonnenschutzmitteln und anderen Kosmetikprodukten als wirksamen UV-Absorber, um die Haut vor UV-Strahlen zu schützen.
- Die Herstellung keramischer Materialien, darunter Elektrokeramik, Katalysatoren und Keramikglasuren, ist in hohem Maße auf Titandioxid als Schlüsselkomponente angewiesen.
- Bei verschiedenen chemischen Reaktionen, unter anderem bei der Herstellung von Polyethylen und anderen Polymeren, fungiert Titandioxid als Katalysator.
- Die Elektronikindustrie verwendet Titandioxid aufgrund seiner hohen Dielektrizitätskonstante und geringen elektrischen Leitfähigkeit bei der Herstellung elektronischer Geräte wie Kondensatoren und Widerstände.
- Um deren Reflexionsvermögen und Haltbarkeit zu verbessern, tragen Hersteller eine dünne Schicht Titandioxid auf Linsen, Spiegel und andere optische Komponenten auf, die in der optischen Beschichtungsindustrie weit verbreitet ist.
- Aufgrund seiner hervorragenden Biokompatibilität und Korrosionsbeständigkeit wird Titandioxid in medizinischen Implantaten, wie z. B. Zahnimplantaten, in biomedizinischen Anwendungen eingesetzt.
Die Vielfalt der Anwendungen von Titanoxid unterstreicht seine Bedeutung in verschiedenen Branchen und sein Potenzial für zukünftige Innovationen.
Fragen: Titandioxid in Lebensmitteln
Titandioxid ist ein Lebensmittelzusatzstoff, der häufig zum Aufhellen und Aufhellen von Lebensmitteln verwendet wird. Auf den Zutatenetiketten von Lebensmitteln wird es oft als E171 oder „Titandioxid“ aufgeführt. Es ist in den Vereinigten Staaten, der Europäischen Union und vielen anderen Ländern als Lebensmittelfarbstoff zugelassen. Hersteller verwenden es, um Lebensmitteln ein weißes, glänzendes Aussehen zu verleihen und die Textur und Konsistenz zu verbessern, darunter Süßigkeiten, Kaugummi, Backwaren, Milchprodukte und Getränke. Darüber hinaus wird es als Lichtstreumittel verwendet, um die Opazität bestimmter Lebensmittelprodukte zu verbessern.
Obwohl Titandioxid allgemein als lebensmittelsicher gilt, besteht die Sorge, dass der Verzehr in großen Mengen schädlich sein könnte. Studien deuten darauf hin, dass Titandioxid-Nanopartikel toxische Auswirkungen auf die menschliche Gesundheit, insbesondere auf das Verdauungssystem, haben könnten. Allerdings sind weitere Untersuchungen erforderlich, um die Sicherheit von Titandioxid in Lebensmitteln zu bestimmen.
Einige Länder haben Maßnahmen ergriffen, um die Verwendung von Titandioxid in Lebensmitteln einzuschränken. Beispielsweise hat Frankreich im Jahr 2020 die Verwendung von Titandioxid als Lebensmittelzusatzstoff verboten, und die Europäische Union überprüft derzeit die Sicherheit von Titandioxid in Lebensmitteln. Verbraucher sollten sich wie bei jedem Lebensmittelzusatzstoff der potenziellen Risiken und Vorteile von Titandioxid bewusst sein und eine fundierte Entscheidung über die von ihnen verzehrten Lebensmittel treffen.
