Tetrafluorethylen oder C2F4 ist ein farb- und geruchloses Gas, das bei der Herstellung von Fluorpolymeren wie Teflon verwendet wird. Es wird auch bei der Herstellung von Kältemitteln und Treibmitteln verwendet.
| Name der IUPAC | Tetrafluorethylen |
| Molekularformel | C2F4 |
| CAS-Nummer | 116-14-3 |
| Synonyme | TFE, Perfluorethylen, Ethen, Tetrafluor-, F4E, Freon 1113, Halogenkohlenwasserstoff 1113 |
| InChI | InChI=1S/C2F4/c3-1(4)2(5)6 |
Lewis-Struktur C2F4
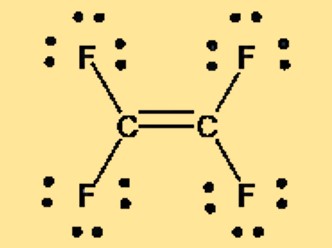
Die Lewis-Struktur von Tetrafluorethylen, auch bekannt als TFE oder C2F4, kann durch zwei doppelt aneinander gebundene Kohlenstoffatome dargestellt werden, wobei jedes Kohlenstoffatom an zwei Fluoratome gebunden ist. Die Lewis-Struktur zeigt die Anordnung der Valenzelektronen im Molekül und gibt Aufschluss über die Bindung und Geometrie des Moleküls. Die unpolare Natur von TFE zeigt sich auch in seiner Lewis-Struktur, die weder Ladungstrennung noch Nettodipolmoment aufweist.
Molmasse von Tetrafluorethylen
Die Molmasse von Tetrafluorethylen, auch TFE oder C2F4 genannt, beträgt 100,02 g/mol. Dieser Wert wird berechnet, indem die Atommassen aller im Molekül vorhandenen Elemente, also zwei Kohlenstoffatome und vier Fluoratome, addiert werden. Die Molmasse ist ein wichtiger Parameter zur Bestimmung der Menge einer Substanz in einem bestimmten Volumen oder einer bestimmten Masse und wird auch in stöchiometrischen Berechnungen verwendet.
Siedepunkt von Tetrafluorethylen
Tetrafluorethylen hat bei Normaldruck einen Siedepunkt von -76,3 °C (-105,34 °F). Es ist ein sehr flüchtiges Gas, das bei Raumtemperatur und Atmosphärendruck schnell verdampfen kann. Der niedrige Siedepunkt von TFE macht es ideal für verschiedene industrielle Anwendungen, beispielsweise in Kühlsystemen und als Treibmittel für Aerosole.
Schmelzpunkt von Tetrafluorethylen
Tetrafluorethylen hat keinen eindeutigen Schmelzpunkt, da es einen direkten Phasenübergang von fest zu gasförmig durchläuft und dabei die flüssige Phase überspringt. Die feste Form von TFE kann jedoch unter Hochdruckbedingungen bei Temperaturen unter -76,3 °C vorliegen. Die feste Form von TFE ist außerdem sehr instabil und reaktiv und kann spontan polymerisieren oder sich zersetzen.
Dichte von Tetrafluorethylen g/ml
Die Dichte von Tetrafluorethylen beträgt bei Standardtemperatur und -druck (STP) 1,47 g/L. Da TFE jedoch ein Gas ist, kann seine Dichte bei Temperatur- und Druckänderungen erheblich variieren. Bei Raumtemperatur und Atmosphärendruck beträgt die Dichte von TFE etwa 3,21 g/L.
Molekulargewicht von Tetrafluorethylen
Das Molekulargewicht von C2F4 beträgt 100,02 g/mol. Dieser Wert wird durch Addition der Atomgewichte aller im Molekül vorhandenen Atome berechnet. TFE hat ein relativ niedriges Molekulargewicht, was zu seiner hohen Flüchtigkeit und seinem niedrigen Siedepunkt beiträgt.
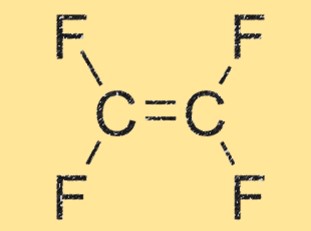
C2F4-Struktur
C2F4 hat eine lineare Struktur mit zwei Kohlenstoffatomen, die doppelt aneinander gebunden sind und jeweils an zwei Fluoratome gebunden sind. Das Molekül ist hochsymmetrisch und hat kein Nettodipolmoment, wodurch es unpolar ist. Die lineare Geometrie von TFE trägt auch zu seiner hohen Reaktivität und Fähigkeit zur Bildung von Polymerketten bei.
Formel C2F4
Die chemische Formel für C2F4 lautet C2F4, was darauf hinweist, dass das Molekül zwei Kohlenstoffatome und vier Fluoratome enthält. Die Formel liefert Informationen über die Art und Anzahl der im Molekül vorhandenen Atome, die bei der Vorhersage seines chemischen Verhaltens und seiner Reaktionen hilfreich sein können.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 1,47 g/L bei STP |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 100,02 g/Mol |
| Dichte | 3,21 g/L bei Raumtemperatur und Atmosphärendruck |
| Fusionspunkt | Hat keinen eindeutigen Schmelzpunkt |
| Siedepunkt | -76,3 °C (-105,34 °F) bei Standarddruck |
| Blitzpunkt | Nicht zutreffend, da TFE ein Gas ist |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Löslich in einigen organischen Lösungsmitteln wie Aceton und Chloroform |
| Dampfdruck | 209,7 kPa bei 20 °C |
| Wasserdampfdichte | 2,95 (Luft = 1) |
| pKa | Nicht zutreffend, da TFE weder eine Säure noch eine Base ist |
| pH-Wert | Nicht zutreffend, da TFE weder eine Säure noch eine Base ist |
Sicherheit und Gefahren von Tetrafluorethylen
Tetrafluorethylen kann bei unsachgemäßer Handhabung mehrere Sicherheits- und Gesundheitsrisiken bergen. Die Einwirkung hoher TFE-Konzentrationen kann zu Reizungen der Augen, der Haut und der Atemwege führen. Eine längere Exposition kann auch zu Lungenschäden führen, einschließlich Lungenödem und Lungenentzündung. TFE ist außerdem ein brennbares Gas, das mit Luft explosive Gemische bilden kann. Daher muss es in speziellen Behältern gelagert und transportiert werden, um die Gefahr eines Brandes oder einer Explosion zu vermeiden. Beim Umgang mit TFE ist es wichtig, geeignete Schutzausrüstung, einschließlich Atemschutz, zu tragen, um eine Exposition zu verhindern und das Risiko gesundheitsschädlicher Auswirkungen zu minimieren.
| Gefahrensymbole | F+ (leicht entzündlich) |
| Sicherheitsbeschreibung | Leicht entzündliches Gas. Verursacht schwere Augenreizung. Kann Reizungen der Atemwege verursachen. |
| UN-Identifikationsnummern | UN1080 |
| HS-Code | 2903.39 |
| Gefahrenklasse | 2.1 (Brennbares Gas) |
| Verpackungsgruppe | Nicht zutreffend, da TFE ein Gas ist |
| Toxizität | TFE hat eine geringe akute Toxizität, eine längere Exposition kann jedoch zu Lungenschäden und anderen gesundheitsschädlichen Auswirkungen führen. TFE gilt auch als potenzielles Karzinogen für den Menschen. |
Methoden zur Synthese von Tetrafluorethylen
Tetrafluorethylen (TFE) kann durch verschiedene Methoden synthetisiert werden, einschließlich der thermischen und katalytischen Zersetzung verschiedener Fluorkohlenstoffverbindungen.
Eine gängige Methode zur Synthese von TFE ist die thermische Zersetzung von Chlordifluormethan (CCl2F2) in Gegenwart eines geeigneten Initiators bei hoher Temperatur. Bei diesem Prozess werden Kohlenstoff-Chlor-Bindungen in CCl2F2 aufgebrochen, um ein Radikal zu bilden, das dann mit anderen Molekülen unter Bildung von TFE reagiert.
Eine weitere Methode ist die katalytische Zersetzung von Fluorkohlenstoffverbindungen wie Hexafluorpropen (HFP) oder Octafluorcyclobutan (OFCB) an einem geeigneten Katalysator, wie Aluminiumchlorid oder Antimonpentafluorid, bei hoher Temperatur. Bei dieser Methode entsteht eine Mischung aus TFE und anderen Fluorkohlenwasserstoff-Nebenprodukten, die dann abgetrennt und gereinigt werden.
Darüber hinaus kann TFE durch elektrochemische Fluorierung synthetisiert werden, ein Prozess, bei dem eine Mischung aus Wasserstoff und Fluorgas in Gegenwart eines Elektrolyten über eine Metallanode geleitet wird. Bei dieser Methode entsteht eine Mischung aus TFE und anderen fluorierten Verbindungen, die dann abgetrennt und gereinigt werden.
Insgesamt erfordert die Synthese von TFE aufgrund der hochreaktiven und gefährlichen Natur der beteiligten Chemikalien spezielle Ausrüstung und Fachwissen. Daher ist es wichtig, bei der Synthese von TFE die entsprechenden Sicherheitsprotokolle und -vorschriften zu befolgen.
Verwendung von Tetrafluorethylen
Tetrafluorethylen (TFE) ist eine vielseitige Chemikalie mit verschiedenen industriellen und kommerziellen Anwendungen.
- Eine der Hauptanwendungen von TFE ist die Verwendung als Monomer für die Herstellung von Polytetrafluorethylen (PTFE), einem nicht haftenden, hitzebeständigen Polymer, das allgemein als Teflon bekannt ist.
- TFE dient als Rohstoff für die Herstellung anderer fluorierter Verbindungen wie perfluorierter Carbonsäuren und Perfluoralkylsulfonate, die in der Elektronik-, Textil- und anderen Industriezweigen Anwendung finden.
- TFE spielt eine entscheidende Rolle bei der Herstellung von Fluorpolymeren wie Polyvinylidenfluorid (PVDF), die aufgrund ihrer hohen chemischen Beständigkeit und Haltbarkeit häufig in Beschichtungen, Rohren und Drähten eingesetzt werden.
- Hersteller verwenden TFE als Kältemittel in Klima- und Kühlsystemen sowie bei der Herstellung von Schaumstoffdämmstoffen.
- Die Pharmaindustrie verwendet TFE als Lösungs- und Treibmittel für Aerosolformulierungen.
- TFE hat viele Anwendungen, darunter Kochgeschirrbeschichtungen, elektrische Isolierung und Hochleistungsdichtungen.
Insgesamt machen die Vielseitigkeit und die einzigartigen Eigenschaften von TFE es zu einer wertvollen Chemikalie in einer Vielzahl industrieller und kommerzieller Anwendungen. Es ist jedoch wichtig, beim Umgang mit TFE die entsprechenden Sicherheitsprotokolle und -vorschriften einzuhalten, um das Risiko gesundheitsschädlicher Auswirkungen und Umweltschäden zu minimieren.
Fragen:
Welche Atom- oder Hybridorbitale bilden die Sigma-Bindung zwischen c2 und f in Tetrafluorethylen, c2f4?
Die Sigma-Bindung zwischen C2 und F in Tetrafluorethylen (C2F4) wird durch die Überlappung von Hybridorbitalen gebildet. In C2F4 ist jedes Kohlenstoffatom sp2-hybridisiert, was bedeutet, dass seine drei Atomorbitale (ein 2s-Orbital und zwei 2p-Orbitale) sich zu drei sp2-hybridisierten Orbitalen verbinden, die in einer trigonal-planaren Geometrie angeordnet sind. Jedes Kohlenstoffatom hat außerdem ein unhybridisiertes 2p-Orbital, das senkrecht zur Ebene der sp2-Orbitale steht.
Das Fluoratom hat ein einfach besetztes 2p-Orbital, das mit dem nichthybridisierten 2p-Orbital des benachbarten Kohlenstoffatoms überlappt, um die Sigma-Bindung zu bilden. Diese Überlappung erfolgt Ende an Ende zwischen den beiden Atomen, was zu einer linearen Anordnung der Atome im Molekül führt. Die Elektronen in der Sigma-Bindung befinden sich hauptsächlich im Bereich zwischen den beiden Kernen, wodurch eine starke kovalente Bindung zwischen den Kohlenstoff- und Fluoratomen entsteht.
Teflon wird aus polymerisiertem Tetrafluorethylen hergestellt?
Ja, Teflon wird durch Polymerisation von Tetrafluorethylen (TFE) hergestellt. TFE ist ein farb- und geruchloses Gas, das in Gegenwart eines Katalysators zu Polytetrafluorethylen (PTFE), allgemein bekannt als Teflon, polymerisiert werden kann.
Der Polymerisationsprozess beinhaltet die Initiierung der Reaktion mithilfe eines Radikalinitiators wie Ammoniumpersulfat oder Azobisisobutyronitril (AIBN), der freie Radikale erzeugt, die die Kettenreaktion der zu PTFE polymerisierten TFE-Monomere initiieren.
