Sulfurylchlorid (SO2Cl2) ist eine Verbindung, die durch die Kombination von Schwefeldioxid und Chlor entsteht. Es wird als Reagens bei chemischen Reaktionen und als Begasungsmittel zur Schädlingsbekämpfung eingesetzt.
| IUPAC-Name | Sulfurylchlorid |
| Molekularformel | SO2Cl2 |
| CAS-Nummer | 7791-25-5 |
| Synonyme | Schwefeldichlorid, Schwefeloxychlorid, Schwefeldichloridoxid |
| InChI | InChI=1S/Cl2O2S/c1-5(2)6(3)4 |
Eigenschaften von Sulfurylchlorid
Sulfurylchlorid-Formel
Die chemische Formel für Schwefeldichlorid lautet SO2Cl2. Es entsteht aus der Kombination eines Schwefelatoms, zweier Sauerstoffatome und zweier Chloratome. Diese Formel stellt die Zusammensetzung und Anordnung der Atome in einem Schwefeldichloridmolekül dar.
Molmasse von Sulfurylchlorid
Die Molmasse von Schwefeldichlorid kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Schwefeldichlorid hat eine Molmasse von etwa 134,97 Gramm pro Mol. Dieser Wert ist für verschiedene Berechnungen chemischer Reaktionen und Stöchiometrie wichtig.
Siedepunkt von Sulfurylchlorid
Schwefeldichlorid hat einen Siedepunkt von etwa 69 Grad Celsius. Wenn die Temperatur über diesen Punkt ansteigt, vollzieht Schwefeldichlorid einen Phasenwechsel und geht von einer Flüssigkeit in einen Gaszustand über. Der Siedepunkt ist ein entscheidender Parameter bei der Bestimmung der Bedingungen, unter denen Schwefeldichlorid verwendet oder gehandhabt werden kann.
Schmelzpunkt von Sulfurylchlorid
Der Schmelzpunkt von Schwefeldichlorid liegt bei etwa -54 Grad Celsius. Bei Temperaturen unterhalb dieses Punktes geht Schwefeldichlorid vom festen in den flüssigen Zustand über. Der Schmelzpunkt ist für die Lagerung und Handhabung von Schwefeldichlorid wichtig, da er die Bedingungen angibt, unter denen es erstarrt oder sich verflüssigt.
Dichte von Sulfurylchlorid g/ml
Die Dichte von Schwefeldichlorid beträgt etwa 1,638 Gramm pro Milliliter (g/ml). Die Dichte stellt die Masse einer Substanz pro Volumeneinheit dar und hilft bei der Bestimmung ihres physikalischen Verhaltens. Die Dichte von Schwefeldichlorid ist wichtig für das Verständnis seines Auftriebs, seiner Löslichkeit und seiner Kompatibilität mit anderen Substanzen.
Molekulargewicht von Sulfurylchlorid
Das Molekulargewicht von Schwefeldichlorid beträgt etwa 134,97 Atommasseneinheiten (u). Es ist die Summe der Atommassen der Atombestandteile eines Schwefeldichloridmoleküls. Das Molekulargewicht liefert wichtige Informationen für verschiedene chemische Berechnungen und zur Bestimmung der Substanzmenge in einer bestimmten Probe.
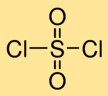
Struktur von Sulfurylchlorid
Schwefeldichlorid hat eine Molekülstruktur, in der ein Schwefelatom an zwei Sauerstoffatome doppelt und an zwei Chloratome einfach gebunden ist. Diese Anordnung bildet ein zentrales Schwefelatom, das von Sauerstoff- und Chloratomen umgeben ist und dem Schwefeldichlorid seine charakteristische Struktur verleiht.
Löslichkeit von Sulfurylchlorid
Schwefeldichlorid ist in Wasser schlecht löslich. Es reagiert mit Wasser zu Salzsäure und Schwefelsäure und ist dadurch hydrolytisch reaktiv. Allerdings weist Schwefeldichlorid eine gewisse Löslichkeit in organischen Lösungsmitteln wie chlorierten Kohlenwasserstoffen und aromatischen Verbindungen auf, wodurch es für bestimmte Anwendungen geeignet ist.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1.638 g/ml |
| Farbe | N / A |
| Geruch | Scharf, erstickend |
| Molmasse | 134,97 g/Mol |
| Dichte | 1.638 g/ml |
| Fusionspunkt | -54°C |
| Siedepunkt | 69°C |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | Reagiert heftig |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie chlorierten Kohlenwasserstoffen und aromatischen Verbindungen |
| Dampfdruck | 43,6 mmHg (bei 25 °C) |
| Wasserdampfdichte | 4,43 (Luft = 1) |
| pKa | N / A |
| pH-Wert | N / A |
Sicherheit und Gefahren von Sulfurylchlorid
Schwefeldichlorid birgt mehrere Sicherheitsrisiken und beim Umgang damit sollten Vorsichtsmaßnahmen getroffen werden. Es handelt sich um eine ätzende Substanz, die bei Kontakt schwere Verätzungen der Haut, Augen und Atemwege verursachen kann. Das direkte Einatmen der Dämpfe kann zu Reizungen der Atemwege und Lungenschäden führen. Es reagiert heftig mit Wasser, setzt giftige Gase frei und es besteht Explosionsgefahr. Daher ist es wichtig, Schwefeldichlorid in einem gut belüfteten Bereich zu handhaben und geeignete Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutz zu tragen. Verschüttungen sollten sofort mit geeigneten Verfahren beseitigt und an einem kühlen, trockenen Ort, entfernt von inkompatiblen Materialien, gelagert werden.
| Gefahrensymbole | Ätzend (C), Oxidierend (O) |
| Sicherheitsbeschreibung | Verursacht schwere Hautverbrennungen und Augenschäden. Reagiert heftig mit Wasser. |
| UN-Identifikationsnummern | UN 1834 (Schwefeldichlorid) |
| HS-Code | 28121000 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II (mittlere Gefahr) |
| Toxizität | Sehr giftig; Gesundheitsschädlich bei Verschlucken, Einatmen oder Aufnahme durch die Haut. |
Methoden zur Synthese von Sulfurylchlorid
Menschen verwenden üblicherweise einige Methoden, um Schwefeldichlorid zu synthetisieren.
Eine Methode beinhaltet die Reaktion zwischen Schwefeldioxid (SO2) und Chlorgas (Cl2) . In Gegenwart eines Katalysators wie Aktivkohle oder Aluminiumchlorid reagieren die Gase unter Bildung von Schwefeldichlorid (SO2Cl2). Diese Reaktion findet im Allgemeinen bei hohen Temperaturen statt, etwa 100 bis 200 °C.
Eine weitere Methode zur Synthese von Schwefeldichlorid beinhaltet die Reaktion von Schwefeltrioxid (SO3) mit Chlorwasserstoff (HCl). Unter kontrollierten Bedingungen verbinden sich diese beiden Verbindungen zu Schwefeldichlorid. Diese Reaktion ist exotherm und findet im Allgemeinen in der Gasphase statt.
Das Thionylchlorid-Verfahren erzeugt Schwefeldichlorid durch die Reaktion von Schwefelsäure (H2SO4) mit Phosphorpentachlorid (PCl5) bei Raumtemperatur. Bei dieser Reaktion entstehen Schwefeldichlorid sowie Nebenprodukte wie Phosphorsäure (H3PO4) und Chlorwasserstoff (HCl). In industriellen Umgebungen wird diese Methode häufig verwendet.
Es ist wichtig zu beachten, dass diese Synthesemethoden aufgrund der Reaktivität und Gefährlichkeit der beteiligten Substanzen einen sorgfältigen Umgang mit den Reagenzien und die Berücksichtigung von Sicherheitsvorkehrungen erfordern.
Darüber hinaus verwenden Chemiker häufig geeignete Geräte wie Kondensatoren und Rückflusssysteme, um die Reaktionsbedingungen zu kontrollieren und eine erfolgreiche Synthese von Schwefeldichlorid sicherzustellen.
Verwendung von Sulfurylchlorid
Schwefeldichlorid (SO2Cl2) findet aufgrund seiner einzigartigen Eigenschaften vielfältige Anwendungen in verschiedenen Branchen. Hier sind einige wichtige Verwendungszwecke von Schwefeldichlorid:
- Chemisches Reagenz: Bei der organischen Synthese wird Schwefeldichlorid typischerweise als vielseitiges chemisches Reagenz verwendet, bei dem es aktiv an verschiedenen Reaktionen teilnimmt, darunter Chlorierung, Sulfonierung und Veresterung, wodurch die Einführung von Chlor-, Schwefel- oder Säurefunktionen in organische Verbindungen ermöglicht wird.
- Pestizid und Begasungsmittel: Schwefeldichlorid wirkt als starkes Begasungsmittel zur Bekämpfung von Schädlingen in gelagertem Getreide, Getreidemühlen und Lebensmittelverarbeitungsbetrieben und beseitigt aktiv Insekten, Larven und Schädlinge, die aufgrund seiner starken bioziden Eigenschaften gelagerte landwirtschaftliche Produkte schädigen können.
- Polymerisation: Bei der Polymerisation spezifischer Monomere wie Vinylchlorid dient Schwefeldichlorid als aktiver Katalysator oder Initiator und erleichtert die Herstellung von Polyvinylchlorid (PVC), einem weit verbreiteten thermoplastischen Polymer mit Anwendungen in der Bau-, Automobil- und Elektrizitätsindustrie.
- Pharmazeutika: Schwefeldichlorid spielt aktiv eine entscheidende Rolle bei der Synthese pharmazeutischer Verbindungen, insbesondere von Sulfonamiden, die essentielle Antibiotika und Therapeutika zur Behandlung verschiedener Infektionen sind.
- Herstellung von Farbstoffen: Schwefeldichlorid ist aktiv an der Herstellung von Farbstoffen beteiligt, insbesondere von solchen, die Schwefel oder Chlor enthalten. Es führt aktiv gewünschte funktionelle Gruppen ein und verbessert die Farbechtheit und Farbstoffstabilität.
- Chemische Zwischenprodukte: Schwefeldichlorid dient als aktives Zwischenprodukt bei der Synthese anderer Chemikalien, darunter Schwefeldioxid, Schwefelsäure und Sulfonylchloride, die in vielen Branchen wie der Waschmittelherstellung, der Kunststoffherstellung und der Pharmaindustrie Anwendung finden.
- Wasseraufbereitung: Zur Wasserreinigung und -desinfektion neutralisiert und beseitigt Schwefeldichlorid aktiv schädliche Bakterien, Viren und andere Mikroorganismen, die in Wasserquellen vorhanden sind.
- Laboranwendungen: Verschiedene Laborverfahren nutzen Schwefeldichlorid aktiv, beispielsweise zum Nachweis und zur Bestimmung von primären und sekundären Aminen. Es reagiert aktiv mit Aminen unter Bildung stabiler Sulfonamide und erleichtert so deren Analyse und Charakterisierung.
Fragen:
F: Wie groß ist die Gesamtzahl der Gramm-Moleküle SO2Cl2 in 13,5 g Sulfurylchlorid?
A: Die Gesamtzahl der Gramm-Moleküle SO2Cl2 in 13,5 g Sulfurylchlorid kann berechnet werden, indem die angegebene Masse durch die Molmasse von SO2Cl2 dividiert wird.
F: Ist SO2Cl2 polar oder unpolar?
A: SO2Cl2 ist aufgrund des Vorhandenseins polarer Bindungen und einer asymmetrischen Molekülgeometrie ein polares Molekül.
F: Wann wird der SO2Cl2-Druck sinken?
A: Der Druckabfall von SO2Cl2 hängt von verschiedenen Faktoren wie Temperatur, Volumen und Reaktionsbedingungen ab. Dies kann nicht allein anhand der Zeit ermittelt werden.
F: Wie hoch ist der Partialdruck von SO2Cl2 in dieser Mischung?
A: Der Partialdruck von SO2Cl2 in einem Gemisch kann mithilfe des idealen Gasgesetzes in Abhängigkeit von Temperatur, Volumen und Stoffmengenanteil bzw. Konzentration von SO2Cl2 bestimmt werden.
F: Welche Arten von intermolekularen Kräften werden zwischen SO2Cl2-Molekülen erwartet?
A: Zu den erwarteten intermolekularen Kräften zwischen SO2Cl2-Molekülen gehören Dipol-Dipol-Wechselwirkungen und London-Dispersionskräfte.
F: An welchem Punkt sinkt der Partialdruck von SO2Cl2 auf ein Zehntel seines Anfangswerts?
A: Die Zeit, die erforderlich ist, damit der Partialdruck von SO2Cl2 auf ein Zehntel seines Anfangswerts absinkt, hängt von den spezifischen Bedingungen des Systems und der Geschwindigkeit der beteiligten chemischen Reaktion ab.
F: Wie groß ist die Molmasse von SO2Cl2?
A: Die Molmasse von SO2Cl2 beträgt etwa 134,97 Gramm pro Mol.
F: Wie ist die Molekülgeometrie von SO2Cl2?
A: Die Molekülgeometrie von SO2Cl2 ist gekrümmt oder V-förmig, mit einem Schwefelatom in der Mitte, das an zwei Sauerstoffatome und zwei Chloratome gebunden ist.
F: Was ist die Lewis-Struktur von SO2Cl2?
A: Die Lewis-Struktur von SO2Cl2 besteht aus einem Schwefelatom, das doppelt an ein Sauerstoffatom gebunden ist, und einer Einfachbindung an ein weiteres Sauerstoffatom, wobei zwei Chloratome an das Schwefelatom gebunden sind.
