Stickstoffwasserstoffsäure (HN3) ist eine leicht flüchtige Verbindung. Es ist farblos und hat einen stechenden Geruch. Es wird bei chemischen Reaktionen eingesetzt und kann giftig und explosiv sein.
| IUPAC-Name | Stickstoffsäure |
| Molekularformel | HN3 |
| CAS-Nummer | 7782-79-8 |
| Synonyme | Azoimid, Hydrogenazid, Azotinsäure, Salpetersäure, Triazoesäure |
| InChI | InChI=1S/HN3/c1-3-2/h1H |
Eigenschaften von Stickstoffwasserstoffsäure
Formel für Stickstoffsäure
Die chemische Formel für Stickstoffwasserstoffsäure lautet HN3. Es besteht aus einem Wasserstoffatom und drei kovalent miteinander verbundenen Stickstoffatomen. Diese einfache Formel stellt die Grundzusammensetzung der Verbindung dar, die für das Verständnis ihrer Eigenschaften und Reaktionen von entscheidender Bedeutung ist.
Molmasse der Stickstoffwasserstoffsäure
Die Molmasse von Wasserstoffazid (HN3) beträgt etwa 43,03 Gramm pro Mol. Dieser Wert ergibt sich aus der Addition der Atommassen eines Wasserstoffatoms (H) und dreier Stickstoffatome (N). Die Molmasse ist für die Berechnung der Stöchiometrie bei chemischen Reaktionen von entscheidender Bedeutung.
Siedepunkt von Stickstoffwasserstoffsäure
Wasserstoffazid hat einen relativ niedrigen Siedepunkt, etwa 37 Grad Celsius (98,6 Grad Fahrenheit). Aufgrund seiner Flüchtigkeit verdampft es bei moderaten Temperaturen leicht in gasförmige Form. Beim Umgang mit dieser Verbindung ist äußerste Vorsicht geboten.
Schmelzpunkt von Stickstoffwasserstoffsäure
Der Schmelzpunkt von Wasserstoffazid liegt bei etwa -80 Grad Celsius (-112 Grad Fahrenheit). Bei dieser Temperatur geht die feste Verbindung in eine flüssige Form über. Da es sehr reaktiv ist, erfordert sein fester Zustand eine ordnungsgemäße Lagerung und Handhabung.
Dichte von Stickstoffwasserstoffsäure g/ml
Die Dichte von Azidwasserstoff beträgt etwa 1,09 Gramm pro Milliliter. Dieser Wert gibt seine Masse pro Volumeneinheit an und spiegelt seine Kompaktheit und Konzentration in einem bestimmten Raum wider. Es ist ein kritischer Parameter für Labormessungen.
Molekulargewicht der Stickstoffwasserstoffsäure
Das Molekulargewicht von Hydrogenazid (HN3) beträgt 43,03 Gramm pro Mol. Es ist die Summe der Atomgewichte der Elemente, die in einem einzelnen Molekül der Verbindung vorhanden sind. Das Molekulargewicht spielt eine entscheidende Rolle bei der Bestimmung seines physikalischen und chemischen Verhaltens.
Struktur von Stickstoffwasserstoffsäure
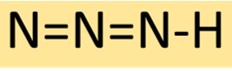
Wasserstoffazid hat eine lineare Molekülstruktur, die aus drei nacheinander verbundenen Stickstoffatomen mit einem einzelnen Wasserstoffatom am Ende besteht. Diese Anordnung führt zu einer stabilen, aber hochreaktiven Verbindung, die häufig in der chemischen Synthese verwendet wird.
Löslichkeit von Stickstoffwasserstoffsäure
Wasserstoffazid ist in Wasser nur begrenzt löslich und daher eine schwer lösliche Verbindung. In wässrigen Lösungen kann es sich in geringem Maße lösen, aber seine geringe Löslichkeit schränkt seinen Einsatz in einigen Anwendungen ein. Aufgrund seiner giftigen und explosiven Natur ist beim Umgang mit seiner wässrigen Form besondere Vorsicht geboten.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1,09 g/ml |
| Farbe | Farblos |
| Geruch | Stechender Geruch |
| Molmasse | 43,03 g/Mol |
| Dichte | 1,09 g/ml |
| Fusionspunkt | -80°C (-112°F) |
| Siedepunkt | 37°C (98,6°F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwach löslich |
| Löslichkeit | Löslich in alkalischen und organischen Lösungsmitteln wie Alkohol, Ether |
| Dampfdruck | 23,1 mmHg bei 20°C |
| Wasserdampfdichte | 1,4 (Luft = 1) |
| pKa | 4.6 |
| pH-Wert | Ungefähr 3-4 |
Sicherheit und Gefahren von Stickstoffwasserstoffsäure
Wasserstoffazid birgt erhebliche Sicherheitsrisiken. Es ist hochgiftig und kann bei Exposition schwerwiegende Gesundheitsschäden verursachen. Das Einatmen seiner Dämpfe oder Nebel kann zu Reizungen der Atemwege, Schwindel und sogar zum Tod führen. Kontakt mit Haut oder Augen kann zu Verbrennungen, Reizungen und Gewebeschäden führen. Die Verbindung ist zudem hochentzündlich und kann explosionsfähige Gemische bilden. Es reagiert heftig mit verschiedenen Stoffen wie Metallen und Oxidationsmitteln. Beim Umgang mit Wasserstoffazid sollten entsprechende Sicherheitsmaßnahmen befolgt werden, einschließlich des Tragens von Schutzkleidung, einer ausreichenden Belüftung und einer sicheren Lagerung, um Unfälle oder Freisetzungen in die Umwelt zu vermeiden. die Umgebung.
| Gefahrensymbole | Totenkopf, ätzend |
| Sicherheitsbeschreibung | Sehr giftig, ätzend |
| UN-Identifikationsnummern | UN1687 |
| HS-Code | 2811.29.10 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | II (mittlere Gefahr) |
| Toxizität | Sehr giftig; kann in geringen Mengen tödlich sein |
Methoden zur Synthese von Stickstoffwasserstoffsäure
Verschiedene Methoden ermöglichen die Synthese von Hydrogenazid.
Ein gängiger Ansatz beinhaltet die Reaktion zwischen Natriumazid (NaN3) und einer Säure wie Schwefelsäure (H2SO4) oder Salzsäure (HCl) . Bei dieser Methode vermischt sich die Säure mit Natriumazid, wodurch Hydrogenazid und das entsprechende Salz der verwendeten Säure entstehen.
Eine andere Methode beinhaltet die Reaktion zwischen Natriumazid und einem Alkylhalogenid wie Methyliodid (CH3I) oder Ethyliodid (C2H5I). Diese als Curtius-Umlagerung bekannte Reaktion führt zur Bildung von Hydrogenazid als Produkt.
Bei der Reaktion zwischen Natriumazid und salpetriger Säure (HNO2) entsteht Wasserstoffazid. Um salpetrige Säure in situ zu erzeugen, wird einer sauren Lösung typischerweise Natriumnitrit (NaNO2) zugesetzt. Bei der Reaktion zwischen Natriumazid und salpetriger Säure entsteht Wasserstoffazid.
Es ist wichtig zu beachten, dass die Synthese von Hydrogenazid eine sorgfältige Handhabung und entsprechende Sicherheitsmaßnahmen erfordert. Aufgrund seiner Toxizität und Explosivität sollten Reaktionen in einem gut belüfteten Bereich unter Verwendung geeigneter Schutzausrüstung und unter Einhaltung etablierter Protokolle durchgeführt werden.
Jede Synthesemethode hat ihre Vorteile und Einschränkungen, und die Wahl der Methode hängt von Faktoren wie der Verfügbarkeit der Reagenzien, der gewünschten Ausbeute und Sicherheitsaspekten ab. Um diese Synthesen effizient und sicher durchzuführen, sind ein gutes Verständnis und Fachwissen im Umgang mit gefährlichen Chemikalien unerlässlich.
Verwendung von Stickstoffwasserstoffsäure
Aufgrund seiner einzigartigen Eigenschaften findet Wasserstoffazid in verschiedenen Bereichen Anwendung. Hier sind einige seiner Verwendungsmöglichkeiten:
- Chemisches Reagens: Wasserstoffazid dient als vielseitiges chemisches Reagens in der organischen Synthese und nimmt aktiv an vielen Reaktionen teil, einschließlich der Synthese von Aziden, die entscheidende Bausteine in Pharmazeutika und Farbstoffen sind.
- Zünder und Treibmittel: Hersteller verwenden Wasserstoffazid für die Herstellung von Zündern und Treibmitteln, die in Airbags und Sicherheitsvorrichtungen verwendet werden, und profitieren von seiner explosiven Natur und schnellen Zersetzung, die aktiv Stickstoffgas freisetzt, was es für diese Anwendungen wertvoll macht.
- Laboranalyse: Die analytische Chemie nutzt Azidwasserstoff zum aktiven Nachweis und zur Bestimmung verschiedener Elemente und Verbindungen. Es bildet aktiv Komplexe mit bestimmten Metallen und ermöglicht so deren Quantifizierung durch kolorimetrische oder Titrationsmethoden.
- Biochemische Forschung: In der biochemischen Forschung nutzen Wissenschaftler aktiv Wasserstoffazid, um Biomoleküle zu modifizieren und ihre Funktionen zu untersuchen. Es reagiert selektiv mit bestimmten funktionellen Gruppen und trägt so aktiv zur Identifizierung und Charakterisierung biologischer Moleküle bei.
- Fotografie: In der traditionellen Schwarzweißfotografie fungiert Wasserstoffazid aktiv als Sensibilisator in Emulsionen, verbessert die Lichtempfindlichkeit von Fotofilmen und führt aktiv zu einer besseren Bildqualität.
- Korrosionsinhibitor: Die Industrie nutzt aktiv Azidwasserstoff als Korrosionsinhibitor für Metalle, insbesondere Kupfer und seine Legierungen. Es bildet aktiv eine Schutzschicht auf der Metalloberfläche, verhindert aktiv Korrosion und verlängert die Lebensdauer verschiedener Geräte und Strukturen.
- Gasgeneratoren: Wasserstoffazid spielt eine aktive Rolle in Gasgeneratoren für Airbags und Rettungssysteme. Durch seine schnelle Zersetzung wird aktiv Stickstoffgas freigesetzt, das die zum Aufblasen und Entfalten erforderliche Kraft liefert.
Fragen:
F: Ist Stickstoffwasserstoffsäure ätzend?
A: Ja, Stickstoffwasserstoffsäure gilt als ätzend und kann bei Kontakt Verbrennungen und Gewebeschäden verursachen.
F: Ist Stickstoffwasserstoffsäure eine starke Säure?
A: Ja, Stickstoffwasserstoffsäure wird als starke Säure eingestuft, die in der Lage ist, in Wasser vollständig zu ionisieren und Hydroniumionen freizusetzen.
F: Ist Stickstoffwasserstoffsäure eine ternäre Säure?
A: Nein, Stickstoffwasserstoffsäure ist keine ternäre Säure. Ternäre Säuren enthalten drei verschiedene Elemente (Wasserstoff, Sauerstoff und ein drittes Element), während Stickstoffsäure nur Wasserstoff, Stickstoff und Sauerstoff enthält.
F: Wie viele ml Stickstoffwasserstoffsäure pro 12,5 ml?
A: Die Frage scheint unvollständig zu sein und erfordert zusätzliche Informationen für eine genaue Antwort.
F: Was ist die korrekte Lewis-Struktur für Stickstoffwasserstoffsäure (HN3), einschließlich etwaiger Formalladungen?
A: Die korrekte Lewis-Struktur für HN3 besteht aus einem zentralen Stickstoffatom, das an drei weitere Stickstoffatome und ein Wasserstoffatom gebunden ist. Formale Ladungen können anhand von Unterschieden in der Elektronegativität bestimmt werden.
F: Wie beeinflusst Stickstoffwasserstoffsäure die Cytochrom-C-Oxidase?
A: Wasserstoffazid hemmt Cytochrom-C-Oxidase, ein Enzym, das an der Zellatmung beteiligt ist, indem es an sein aktives Zentrum bindet und seine Funktion stört.
F: Wie groß ist der Ka-Wert von Stickstoffwasserstoffsäure, wenn 0,20 M Stickstoffwasserstoffsäure einen pH-Wert von 3,21 hat?
A: Der Ka von Stickstoffwasserstoffsäure kann mithilfe des pH-Werts und der Gleichung Ka = [H3O+][A-]/[HA] berechnet werden. Zur Bestimmung des Ka-Wertes sind weitere Informationen erforderlich.
F: Welche Oxidationsstufe hat Stickstoff in Stickstoffwasserstoffsäure (HN3)?
A: Die Oxidationsstufe von Stickstoff in Stickstoffwasserstoffsäure beträgt -1.
F: Wie hoch ist der pH-Wert einer 0,15 molaren Lösung von HN3, wenn Ka = 1,8 × 10^-9?
A: Der pH-Wert einer 0,15 molaren Lösung von HN3 kann mithilfe des Ka-Werts und der Gleichung pH = -log10(sqrt(Ka × [HA])) berechnet werden.
F: Wie kann man N2 + H2 in HN3 ausgleichen?
A: Die ausgeglichene Gleichung für die Reaktion N2 + H2 → HN3 wäre 3N2 + 6H2 → 2HN3.
F: Wie berechnet man den Ka von HN3?
A: Der Ka von HN3 kann anhand der Gleichgewichtskonzentration der Produkte und Reaktanten in der HN3-Dissoziationsreaktion berechnet werden.
F: Wie hoch ist die Molarität von NaN3, wenn die Molarität von HN3 0,012 M beträgt?
A: Die Molarität von NaN3 kann nicht ohne zusätzliche Informationen oder die ausgewogene Gleichung für die Reaktion zwischen NaN3 und HN3 bestimmt werden.
F: Was ist die korrekte Lewis-Struktur für Stickstoffwasserstoffsäure (HN3), einschließlich etwaiger Formalladungen?
A: Die korrekte Lewis-Struktur für HN3 umfasst ein zentrales Stickstoffatom, das an drei andere Stickstoffatome und ein Wasserstoffatom gebunden ist. Formale Ladungen können anhand von Unterschieden in der Elektronegativität bestimmt werden.
