Silbersulfat (Ag2SO4) ist ein weißer Feststoff, der in der Fotografie und analytischen Chemie verwendet wird. Es löst sich in Wasser und zerfällt beim Erhitzen in Silberoxid und Schwefeltrioxid.
| IUPAC-Name | Silbersulfat |
| Molekularformel | Ag2SO4 |
| CAS-Nummer | 10294-26-5 |
| Synonyme | Silbersulfat, Disilversulfat, Silberschwefelsäure, Disilvermonosulfat |
| InChI | InChI=1S/2Ag.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Eigenschaften von Silbersulfat
Silbersulfat-Formel
Die chemische Formel für Disilbersulfat lautet Ag2SO4. Es besteht aus zwei Silberatomen (Ag), die an ein Schwefelatom (S) und vier Sauerstoffatome (O) gebunden sind. Die Formel gibt das Verhältnis der Atome in einem Molekül Disilbersulfat an.
Molmasse von Silbersulfat
Die Molmasse von Disilversulfat wird durch Addition der Atommassen seiner Bestandteile berechnet. Silber hat eine Atommasse von 107,87 Gramm pro Mol (g/mol), Schwefel hat eine Atommasse von 32,07 g/mol und Sauerstoff hat eine Atommasse von 16,00 g/mol. Zusammengenommen beträgt die Molmasse von Disilbersulfat etwa 311,81 g/mol.
Siedepunkt von Silbersulfat
Disilbersulfat hat keinen ausgeprägten Siedepunkt, da es sich vor Erreichen seines Siedepunkts zersetzt. Beim Erhitzen unterliegt es einer thermischen Zersetzung und zerfällt in Silberoxid (Ag2O) und Schwefeltrioxid (SO3). Daher ist der Siedepunkt von Disilbersulfat nicht anwendbar.
Schmelzpunkt von Silbersulfat
Der Schmelzpunkt von Disilbersulfat liegt bei etwa 652 Grad Celsius (1.206 Grad Fahrenheit). Bei dieser Temperatur geht das Silbersulfat vom festen in den geschmolzenen, flüssigen Zustand über. Es ist wichtig zu beachten, dass der Schmelzpunkt je nach Reinheit der Farbstoffsulfatprobe leicht variieren kann.
Dichte von Silbersulfat g/ml
Die Dichte von Disilbersulfat beträgt etwa 5,45 Gramm pro Milliliter (g/ml). Dieser Wert gibt die Masse an Disilbersulfat pro Volumeneinheit an. Die Dichte einer Substanz hängt im Allgemeinen von der Temperatur ab, daher ist es wichtig, die Bedingungen bei der Messung der Dichte von Disilbersulfat zu berücksichtigen.
Molekulargewicht von Silbersulfat
Das Molekulargewicht von Disilbersulfat wird durch Addition der Atomgewichte seiner Bestandteile unter Berücksichtigung der Stöchiometrie der Formel berechnet. Im Fall von Disilversulfat (Ag2SO4) beträgt das Molekulargewicht etwa 311,81 Gramm pro Mol (g/mol).
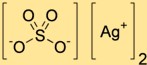
Struktur von Silbersulfat
Disilversulfat hat eine Kristallstruktur bestehend aus Silberkationen (Ag+) und Sulfatanionen (SO4^2-). Die Silberkationen sind von Sauerstoffatomen aus Sulfatanionen umgeben und bilden so ein dreidimensionales Netzwerk.
Löslichkeit von Silbersulfat
Diargentsulfat ist in Wasser schlecht löslich. Es löst sich in begrenztem Maße auf, etwa 0,8 Gramm lösen sich in 100 Milliliter Wasser bei Raumtemperatur auf. Die Löslichkeit kann durch Faktoren wie Temperatur und das Vorhandensein anderer gelöster Stoffe in der Lösung beeinflusst werden.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | N / A |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 311,81 g/Mol |
| Dichte | 5,45 g/ml |
| Fusionspunkt | 652 °C (1206 °F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löst sich in wässriger Lösung auf. Säuren, Alkohole, Aceton, Ether, Acetate, Amide |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | N / A |
| pH-Wert | N / A |
Sicherheit und Gefahren von Silbersulfat
Diargentsulfat birgt einige Sicherheitsrisiken und daher ist bei der Handhabung Vorsicht geboten. Es ist wichtig, das Einatmen, Verschlucken oder den Kontakt mit Haut und Augen zu vermeiden. Beim Umgang mit Disilbersulfat wird das Tragen geeigneter persönlicher Schutzausrüstung, einschließlich Handschuhen, Schutzbrille und Laborkittel, empfohlen. Im Falle einer versehentlichen Exposition die betroffenen Stellen gründlich mit Wasser abspülen. Diargentsulfat kann Haut- und Augenreizungen verursachen und eine längere oder wiederholte Exposition kann zu einer Sensibilisierung führen. Außerdem ist es notwendig, Disilbersulfat in einem gut belüfteten Bereich zu handhaben, um das Risiko einer Inhalation zu minimieren. Um die Sicherheit zu gewährleisten, müssen ordnungsgemäße Lagerungs-, Kennzeichnungs- und Entsorgungsverfahren befolgt werden.
| Gefahrensymbole | Kein Symbol |
| Sicherheitsbeschreibung | Einatmen, Verschlucken und Kontakt mit Haut und Augen vermeiden. Tragen Sie PSA. In einem gut belüfteten Bereich handhaben. Ordnungsgemäße Lagerung, Kennzeichnung und Entsorgung. |
| UN-Identifikationsnummern | N / A |
| HS-Code | 28429090 |
| Gefahrenklasse | N / A |
| Verpackungsgruppe | N / A |
| Toxizität | Reizt Haut und Augen. Längerer/wiederholter Kontakt kann zu einer Sensibilisierung führen. |
Methoden zur Synthese von Silbersulfat
Es gibt verschiedene Methoden zur Synthese von Disilbersulfat.
Eine gängige Methode beinhaltet die Reaktion zwischen Silbernitrat (AgNO3) und Schwefelsäure (H2SO4) . Im Labor geben Wissenschaftler unter Rühren langsam Silbernitrat zu einer Schwefelsäurelösung hinzu, was zur Bildung eines weißen Niederschlags namens Diargentsulfat führt. Sie sammeln den Niederschlag, waschen ihn und trocknen ihn, um reines Disilbersulfat zu erhalten.
Wissenschaftler erhalten Silbersulfat auch, indem sie Schwefelsäure Silberoxid (Ag2O) hinzufügen und die Mischung unter Rühren erhitzen. Bei diesem Verfahren fällt Disilbersulfat aus, das filtriert, gewaschen und getrocknet wird, um das Endprodukt zu erhalten.
Darüber hinaus können Wissenschaftler Silbersulfat gewinnen, indem sie eine Mischung aus Silberchlorid (AgCl) und konzentrierter Schwefelsäure erhitzen. Sie fügen der Schwefelsäure Silberchlorid hinzu und erhitzen die Mischung. Die Reaktion führt zur Bildung von Silbersulfat als Niederschlag, der gesammelt, gewaschen und getrocknet werden kann.
Es ist wichtig zu beachten, dass diese Synthesemethoden mit entsprechenden Sicherheitsvorkehrungen durchgeführt werden sollten, einschließlich der Verwendung geeigneter Schutzausrüstung und des Arbeitens in einem gut belüfteten Bereich.
Verwendungsmöglichkeiten von Silbersulfat
Aufgrund seiner einzigartigen Eigenschaften findet Disilversulfat vielfältige Einsatzmöglichkeiten in unterschiedlichen Bereichen. Hier sind einige seiner häufigsten Anwendungen:
- Fotografie: In der Schwarzweißfotografie verwenden Fotografen Disilbersulfat als Bestandteil lichtempfindlicher Emulsionen, um Bilder durch Reaktion mit Licht aufzunehmen und zu entwickeln.
- Analytische Chemie: Verschiedene Analysemethoden verwenden Silbersulfat als Reagenz, um Halogenide wie Chlorid- und Bromidionen durch Fällungsreaktionen nachzuweisen und zu quantifizieren.
- Galvanisieren: Beim Galvanisieren wird Silbersulfat verwendet, um eine Silberschicht auf leitenden Oberflächen abzuscheiden und so dekorative oder schützende Beschichtungen auf Schmuck, elektronischen Geräten und anderen Gegenständen zu erzeugen.
- Antimikrobielles Mittel: Aufgrund seiner antimikrobiellen Eigenschaften findet Diargentsulfat Anwendung bei der Formulierung von Verbänden, Salben und medizinischen Geräten. Es beugt Infektionen vor und fördert die Heilung.
- Batterieindustrie: Die Batterieindustrie verwendet es als entscheidenden Bestandteil von Elektrodenmaterial für die Herstellung von Silber-Zink- und Silber-Cadmium-Batterien, die in elektronischen Geräten und medizinischen Geräten weit verbreitet sind.
- Laborreagenz: Disilversulfat wird als Reagenz in einer Vielzahl von Laborexperimenten verwendet, einschließlich der Synthese anderer Silberverbindungen und in Reaktionen der organischen Chemie.
- Glasherstellung: In der Glasherstellung spielt es eine entscheidende Rolle bei der Herstellung von Spezialglas, einschließlich versilberter Spiegel und leitfähiger Fensterbeschichtungen. Um diese gewünschten Eigenschaften zu erzielen, tragen die Hersteller eine dünne Schicht Silbersulfat auf.
- Katalysator: Disilversulfat wirkt als Katalysator bei bestimmten chemischen Reaktionen, einschließlich Oxidationsreaktionen und Polymerisationsprozessen.
Fragen:
F: Was entsteht sonst noch bei der Austauschreaktion von Silbernitrat und Kaliumsulfat?
A: Bei der Austauschreaktion von AgNO3 und K2SO4 entstehen als Produkte Kaliumnitrat (KNO3) und Silbersulfat (Ag2SO4).
F: Löst sich das Silbersulfat auf, wenn der Lösung weiteres festes Silbersulfat zugesetzt wird?
A: Ja, zusätzliches festes Disilversulfat löst sich in der Lösung auf, da es in Wasser schlecht löslich ist.
F: Kommt es zu Ausfällungen, wenn Silbernitrat + Natriumsulfat verwendet werden?
A: Ja, es kommt zur Ausfällung, wenn AgNO3 mit Natriumsulfat reagiert, was zur Bildung eines festen Ag2SO4-Niederschlags führt.
F: Wie hoch ist der Silberanteil in Silbersulfat?
A: Der Anteil an Ag im Diargentsulfat beträgt etwa 63,48 %.
F: Ist Silbersulfat löslich oder unlöslich?
A: Diargentsulfat ist in Wasser schlecht löslich.
F: Wie finde ich die chemische Formel von Silbersulfat?
A: Die chemische Formel von Disilversulfat lautet Ag2SO4, die anhand der Wertigkeit des Ag+-Kations und des SO4-2-Anions bestimmt werden kann.
F: Welche Farbe hat Ag2SO4?
A: Disilversulfat (Ag2SO4) ist ein weißer Feststoff.
F: Wie hoch ist der Ksp-Wert für Ag2SO4, wenn 5,49 g in 1,00 l Wasser löslich sind?
A: Der Wert der Löslichkeitsproduktkonstante (Ksp) für Ag2SO4 kann anhand der bereitgestellten Informationen berechnet werden, hierfür sind jedoch zusätzliche Daten zur Dissoziation von Ag2SO4 in Wasser erforderlich.
F: Wie groß ist die Molmasse von Ag2SO4?
A: Die Molmasse von Ag2SO4 beträgt etwa 311,81 g/mol.
F: Entsteht festes Ag2SO4, wenn 2,7 g in 100 ml Wasser gelöst werden?
A: Ja, es kann sich etwas festes Ag2SO4 bilden, wenn es die Löslichkeitsgrenze von Disilbersulfat in 100 ml Wasser überschreitet.
