Silbernitrat (AgNO3) ist eine chemische Verbindung aus Silber, Stickstoff und Sauerstoff. Es wird häufig in der Fotografie, der Medizin und als Laborreagenz für verschiedene Reaktionen verwendet.
| IUPAC-Name | Silbernitrat |
| Molekularformel | AgNO3 |
| CAS-Nummer | 7761-88-8 |
| Synonyme | Silbermononitrat, Silber(1+)salz der Salpetersäure, Silber(I)nitrat |
| InChI | InChI=1S/Ag.NO3/c;2-1(3)4/q+1;-1 |
Eigenschaften von Silbernitrat
Silbernitrat-Formel
Die Formel für Silbermononitrat lautet AgNO3. Es besteht aus einem Silberatom (Ag), einem Stickstoffatom (N) und drei Sauerstoffatomen (O). Die Formel gibt das Verhältnis der Atome in einem Molekül Silbermononitrat an.
Molmasse von Silbernitrat
Die Molmasse von Silbermononitrat wird durch Addition der Atommassen seiner Bestandteile berechnet. Silber hat eine Atommasse von 107,87 g/mol, Stickstoff hat eine Masse von 14,01 g/mol und jedes Sauerstoffatom hat eine Masse von 16,00 g/mol. Ihre Zugabe ergibt eine Molmasse von etwa 169,87 g/mol für Silbermononitrat.
Siedepunkt von Silbernitrat
Silbermononitrat hat einen Siedepunkt von etwa 440 Grad Celsius (824 Grad Fahrenheit). Bei dieser Temperatur vollzieht die Verbindung einen Phasenübergang vom flüssigen in den gasförmigen Zustand. Der Siedepunkt gibt die Temperatur an, bei der der Dampfdruck des Stoffes dem Atmosphärendruck entspricht.
Silbernitrat Schmelzpunkt
Der Schmelzpunkt von Silbermononitrat liegt bei etwa 209 Grad Celsius (408 Grad Fahrenheit). Dies ist die Temperatur, bei der die feste Form von Silbermononitrat flüssig wird. Der Schmelzpunkt ist eine charakteristische Eigenschaft eines Stoffes und hilft bei der Bestimmung seines physikalischen Verhaltens unter verschiedenen Bedingungen.
Dichte von Silbernitrat g/ml
Die Dichte von Silbermononitrat beträgt etwa 4,35 g/ml. Die Dichte ist ein Maß für die Massemenge, die in einem bestimmten Volumen enthalten ist. Sie wird berechnet, indem man die Masse eines Stoffes durch sein Volumen dividiert. Die Dichte von Silbermononitrat gibt an, wie kompakt es ist bzw. wie konzentriert es in einem bestimmten Raum ist.
Molekulargewicht von Silbernitrat
Das Molekulargewicht von Silbermononitrat, auch Molmasse genannt, beträgt etwa 169,87 g/mol. Sie stellt die Summe der Atommassen aller Atome in einem Silbermononitratmolekül dar. Das Molekulargewicht wird bei verschiedenen Berechnungen und Umrechnungen verwendet, die Mengen der Verbindung betreffen.
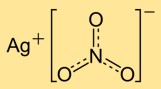
Struktur von Silbernitrat
Silbermononitrat hat eine Kristallstruktur bestehend aus Silberkationen (Ag+) und Nitrat-Anionen (NO3-). Die Silberionen sind von Nitrationen umgeben und bilden so ein regelmäßiges Netzwerk. Diese Ionenstruktur trägt zur Stabilität und den Eigenschaften der Verbindung bei.
Löslichkeit von Silbernitrat
Silbermononitrat ist in Wasser sehr gut löslich. Es löst sich leicht in Wasser und bildet eine klare, farblose Lösung. Die Löslichkeit von Silbermononitrat in Wasser ist eine wesentliche Eigenschaft und spielt in verschiedenen Anwendungen, etwa in der Medizin, Fotografie und bei chemischen Reaktionen, eine entscheidende Rolle.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 4,35 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 169,87 g/Mol |
| Dichte | 4,35 g/ml |
| Fusionspunkt | 209 °C (408 °F) |
| Siedepunkt | 440 °C (824 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser und organischen Lösungsmitteln wie Ethanol |
| Dampfdruck | 0,26 mmHg bei 25 °C (77 °F) |
| Wasserdampfdichte | Unzutreffend |
| pKa | – |
| pH-Wert | Sauer (ungefähr pH 5-6 in wässriger Lösung) |
Sicherheit und Gefahren von Silbernitrat
Silbermononitrat birgt einige Sicherheitsrisiken und beim Umgang mit der Verbindung ist Vorsicht geboten. Es gilt als gesundheitsschädlich, wenn es verschluckt, eingeatmet oder mit der Haut oder den Augen in Berührung kommt. Es sollten Schutzmaßnahmen wie Handschuhe, Schutzbrille und Laborkittel verwendet werden. Dies kann zu Reizungen, Verbrennungen und Flecken auf der Haut und anderen Oberflächen führen. Beim Erhitzen können giftige Stickoxide freigesetzt werden. Es sollte an einem kühlen, trockenen Ort, entfernt von unverträglichen Substanzen, gelagert werden. Verschüttungen sollten umgehend beseitigt werden und die Abfallentsorgung sollte den entsprechenden Richtlinien folgen, um eine Kontamination der Umwelt zu vermeiden.
| Gefahrensymbole | Ätzend, oxidierend |
| Sicherheitsbeschreibung | Verursacht schwere Hautverbrennungen und Augenschäden. |
| Identifikatoren der Vereinten Nationen | UN 1493 (Festes Silbermononitrat) |
| HS-Code | 2843.10.00 |
| Gefahrenklasse | Klasse 5.1 (Oxidierende Stoffe) |
| Verpackungsgruppe | GE II (Mittelstufe) |
| Toxizität | Giftig für Wasserorganismen mit langfristiger Wirkung. |
Methoden zur Silbernitrat-Synthese
Es gibt verschiedene Methoden zur Synthese von Silbermononitrat.
Eine übliche Methode beinhaltet die Reaktion zwischen metallischem Silber und Salpetersäure . Bei diesem Verfahren löst verdünnte Salpetersäure Silber auf und erzeugt Silbermononitrat. Eine andere Methode beinhaltet die Reaktion von Silberoxid oder Silbercarbonat mit Salpetersäure, was zur Bildung von Silbermononitrat führt.
Darüber hinaus kann durch die Reaktion zwischen Silberchlorid und Salpetersäure auch Silbermononitrat entstehen. Salpetersäure löst Silberchlorid, verdrängt die Chloridionen und bildet Silbermononitrat.
Darüber hinaus ermöglicht die Reaktion von Silbersulfat mit einem löslichen Nitratsalz wie Natriumnitrat die Gewinnung von Silbermononitrat. Silbersulfat reagiert mit Nitratsalz in einer wässrigen Lösung, was zur Bildung von Silbermononitrat und einem löslichen Sulfatsalz führt.
Bei der Umsetzung dieser Synthesemethoden ist es wichtig, entsprechende Sicherheitsvorkehrungen zu treffen und ätzende Säuren und potenziell toxische Verbindungen zu verwenden. Außerdem sollten Laborprotokolle und -richtlinien befolgt werden, um eine genaue Zubereitung und Handhabung von Silbermononitrat sicherzustellen.
Verwendung von Silbernitrat
Silbermononitrat hat viele Einsatzmöglichkeiten in verschiedenen Bereichen. Hier sind einige häufige Anwendungen:
- Fotografie: Bei der traditionellen Schwarzweißfotografie wird Silbermononitrat als lichtempfindliche Verbindung verwendet, die mit Licht reagiert, Silberpartikel bildet und fotografische Bilder entwickelt.
- Medizin: Medizinische Anwendungen nutzen Silbermononitrat aufgrund seiner antiseptischen Eigenschaften in der Wundversorgung. Seine topische Anwendung beugt Infektionen vor, stimuliert die Heilung und behandelt Verbrennungen, Geschwüre und andere Hautwunden.
- Laborreagenz: Silbermononitrat dient als vielseitiges Laborreagenz, das verschiedene chemische Reaktionen ermöglicht und in der analytischen Chemie zum Nachweis des Vorhandenseins von Halogeniden und anderen Verbindungen verwendet wird.
- Versilberung: Bei galvanischen Verfahren wird Silbermononitrat verwendet, um aktiv eine dünne Silberschicht auf verschiedenen Oberflächen abzuscheiden. Diese Verwendung erfolgt häufig zu dekorativen Zwecken und zur Gewährleistung der Korrosionsbeständigkeit.
- Färbung und Färbung: In der Histologie und Mikroskopie wird Silbermononitrat als Farbstoff eingesetzt, um die Sichtbarkeit spezifischer Strukturen in biologischen Proben aktiv zu verbessern. Die Textilindustrie nutzt es zum Färben von Stoffen.
- Gravur: Die korrosive Natur von Silbermononitrat ermöglicht seine aktive Verwendung beim Ätzen von Mustern auf Glas und Spiegeln. Es entfernt selektiv Oberflächenschichten und erzeugt so komplexe Muster.
- Chemieunterricht: Bildungseinrichtungen nutzen Silbermononitrat aufgrund seiner ausgeprägten Reaktionen und visuellen Effekte aktiv zur Durchführung chemischer Experimente und Demonstrationen.
- Silberkatalysator: Bei einigen chemischen Reaktionen fungiert Silbermononitrat aktiv als Katalysator und erleichtert die Umwandlung von Reaktanten in die gewünschten Produkte.
Fragen:
F: Ist AgNO3 wasserlöslich?
A: Ja, AgNO3 ist wasserlöslich.
F: Was ist AgNO3?
A: AgNO3 ist Silbermononitrat, eine chemische Verbindung aus Silber, Stickstoff und Sauerstoff.
F: Was sind die Zuschauerionen bei der Reaktion zwischen KCl(aq) und AgNO3(aq)?
A: Bei der Reaktion zwischen KCl(aq) und AgNO3(aq) sind die Zuschauerionen K+ und NO3-.
F: Welche Ionen, wenn überhaupt, sind Zuschauerionen in der Reaktion AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)?
A: In der Reaktion AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq) sind die Zuschauerionen Na+ und NO3-.
F: Wie viele Mol Cu werden benötigt, um mit 5,8 Mol AgNO3 zu reagieren?
A: Die ausgeglichene Gleichung ist notwendig, um die Anzahl der Mol Cu zu bestimmen, die für die Reaktion mit 5,8 Mol AgNO3 erforderlich sind.
F: Welche der folgenden Verbindungen führt zu einem Niederschlag mit AgNO3?
A: Verbindungen, die Cl-, Br- oder I-Ionen enthalten, erzeugen einen Niederschlag mit AgNO3.
F: Ist AgNO3 eine ionische Verbindung?
A: Ja, AgNO3 ist eine ionische Verbindung.
F: Ist AgNO3 ein starker Elektrolyt?
A: Ja, AgNO3 ist ein leistungsstarker Elektrolyt.
F: Leitet AgNO3 Strom?
A: Ja, AgNO3 leitet Strom, wenn es in Wasser gelöst wird.
F: Ist Silbernitrat ein Salz?
A: Ja, Silbermononitrat ist ein Salz.
F: Kann ich Silbernitrat kaufen?
A: Ja, Silbermononitrat ist im Handel erhältlich.
F: Ist Silbernitrat eine Lösung?
A: Silbermononitrat kann je nach Zustand in fester Form oder in Lösungsform vorliegen.
F: Wie entferne ich Silbernitratflecken?
A: Silbermononitratflecken können durch Behandlung der betroffenen Stelle mit einem milden Reduktionsmittel wie Wasserstoffperoxid oder Natriumthiosulfat entfernt werden.
F: Ist Silbernitrat wasserlöslich?
A: Ja, Silbermononitrat ist wasserlöslich.
F: Welcher Niederschlag entsteht, wenn Lösungen von Silbernitrat und Kaliumchromat gemischt werden?
A: Wenn Lösungen aus Silbermononitrat und Kaliumchromat gemischt werden, bildet sich ein gelber Niederschlag aus Silberchromat (Ag2CrO4).
F: Wie groß ist die Molmasse von Silbernitrat?
A: Die Molmasse von Silbermononitrat (AgNO3) beträgt etwa 169,87 g/mol.
F: Einer Lösung von Blei(II)-nitrat wird metallisches Silber zugesetzt. Was ist die ausgewogene chemische Reaktion?
A: Die ausgewogene chemische Reaktion ist 2Ag + Pb(NO3)2 → 2AgNO3 + Pb.
