Salpetersäure (HNO3) ist eine starke und hochreaktive anorganische Säure. Es wird in Düngemitteln, Sprengstoffen sowie in der Textilfärbe- und Druckindustrie eingesetzt. Außerdem bildet es Nitrate, die bei biologischen Prozessen und Verbrennungsreaktionen eine wichtige Rolle spielen.
| IUPAC-Name | Salpetersäure |
| Molekularformel | HNO3 |
| CAS-Nummer | 7697-37-2 |
| Synonyme | Aqua fortis, Salpetergeist, salpetrige Säure |
| InChI | InChI=1S/HNO3/c2-1(3)4 |
Eigenschaften von Salpetersäure
Molmasse von Salpetersäure
Die Molmasse von Salpetersäure beträgt 63,01 g/mol. Dabei handelt es sich um die Substanzmenge, die die gleiche Anzahl an Einheiten (z. B. Atome, Moleküle oder Ionen) enthält wie 12 Gramm reinen Kohlenstoff-12.
Salpetersäure-Formel
Die chemische Formel für Salpetersäure lautet HNO<sub>3</sub>. Es gibt die Anzahl und Art der Atome im Molekül an. Mithilfe der Formel können seine physikalischen und chemischen Eigenschaften wie Siedepunkt, Schmelzpunkt und Dichte vorhergesagt werden.
Siedepunkt von Salpetersäure
Der Siedepunkt von Salpetersäure liegt bei 83,0 °C (181,4 °F). Es ist die Temperatur, bei der ein Stoff bei einem bestimmten Druck von einer Flüssigkeit in einen Gaszustand übergeht. Salpetersäure ist eine hochreaktive und flüchtige Substanz, und der Siedepunkt bestimmt die Bedingungen, unter denen sie gehandhabt und gelagert werden sollte.
Schmelzpunkt von Salpetersäure
Der Schmelzpunkt von Salpetersäure liegt bei -41,5 °C (-42,7 °F). Es ist die Temperatur, bei der ein fester Stoff seinen Zustand in einen flüssigen Zustand überführt. Der niedrige Schmelzpunkt von Salpetersäure erleichtert die Handhabung in flüssiger Form.
Dichte von Salpetersäure g/ml
Die Dichte von Salpetersäure beträgt 1,51 g/ml. Es ist ein Maß für die Masse pro Volumeneinheit eines Stoffes. Die Dichte von Salpetersäure kann dabei helfen, ihre Lagerungs- und Handhabungsanforderungen sowie ihr Potenzial zur Reaktion mit anderen Substanzen zu bestimmen.
Molekulargewicht von Salpetersäure
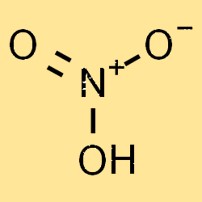
Das Molekulargewicht von Salpetersäure beträgt 63,01 g/mol. Es ist die Summe der Atomgewichte der einzelnen Atome im Molekül. Das Molekulargewicht der Salpetersäure ist ein wichtiger Faktor bei der Bestimmung ihrer physikalischen und chemischen Eigenschaften.
Struktur von Salpetersäure
Salpetersäure ist eine farblose, hochreaktive und flüchtige Flüssigkeit. Seine Molekülstruktur besteht aus einem Stickstoffatom, einem Wasserstoffatom und drei Sauerstoffatomen und bildet die chemische Formel HNO3. Die Sauerstoffatome sind in einer trigonal-planaren Anordnung um das Stickstoffatom angeordnet.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1,51 g/ml |
| Farbe | Farblos |
| Geruch | Stechender, stechender Geruch |
| Molmasse | 63,01 g/Mol |
| Dichte | 1,51 g/ml |
| Fusionspunkt | -41,5 °C (-42,7 °F) |
| Siedepunkt | 83,0 °C (181,4 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Mischbar |
| Löslichkeit | Löslich in Alkohol, Ether und anderen polaren Lösungsmitteln |
| Dampfdruck | Bei Zimmertemperatur aufgezogen |
| Wasserdampfdichte | 1,48 (Luft = 1) |
| pKa | -1.3 |
| pH-Wert | 1 (10 %ige Lösung) |
Hinweis: Der Flammpunkt von Salpetersäure ist nicht anwendbar, da es sich um eine Flüssigkeit handelt. Der pH-Wert einer 10 %igen Salpetersäurelösung beträgt 1, was darauf hinweist, dass es sich um eine starke Säure handelt. Der pKa ist der negative Logarithmus der Säuredissoziationskonstante, die ein Maß für die Stärke einer Säure in Lösung ist.
Sicherheit und Gefahren von Salpetersäure
Salpetersäure ist eine hochreaktive und ätzende Substanz, die bei unsachgemäßer Handhabung zu schweren Verletzungen oder zum Tod führen kann. Dies kann zu Verbrennungen, Augenschäden und Reizungen der Atemwege führen. Beim Umgang mit Salpetersäure ist entsprechende Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Lagerbereiche sollten gut belüftet sein und verschüttete Flüssigkeiten sollten umgehend beseitigt werden, um die Freisetzung giftiger Dämpfe zu verhindern. Bei Haut- oder Augenkontakt spülen Sie die betroffene Stelle mindestens 20 Minuten lang mit Wasser und suchen Sie sofort einen Arzt auf.
| Gefahrensymbole | Umweltgefährlich, Brandfördernd, Gesundheitsschädlich, Reizend |
| Sicherheitsbeschreibung | S2 – Außerhalb der Reichweite von Kindern aufbewahren. S23 – Dämpfe nicht einatmen. S24/25 – Kontakt mit Haut und Augen vermeiden. S26 – Bei Augenkontakt sofort mit viel Wasser spülen und einen Arzt konsultieren. |
| UN-Identifikationsnummern | UN 2031 |
| HS-Code | 2811.90.90 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | III |
| Toxizität | Sehr giftig beim Verschlucken und Einatmen. Kann schwere Verbrennungen und Augenschäden sowie Reizungen der Atemwege verursachen. |
Methoden zur Salpetersäuresynthese
Salpetersäure kann auf verschiedene Weise synthetisiert werden, darunter:
- Ostwald-Verfahren: Bei diesem Verfahren wird Ammoniak mit Luft zu Stickstoffmonoxid oxidiert, das dann zu Salpetersäure oxidiert wird.
- Toluol-Nitrierung: Bei dieser Methode wird Toluol zu Nitrotoluol nitriert, das dann zu Salpetersäure oxidiert wird.
- Thermische Zersetzung von Ammoniumnitrat: Bei dieser Methode wird Ammoniumnitrat erhitzt, um Stickoxid zu erzeugen, das dann zu Salpetersäure oxidiert wird.
- Direkte Oxidation von Ammoniak : Bei dieser Methode wird Ammoniak direkt mit Sauerstoff oxidiert, um Salpetersäure zu erzeugen.
- Natriumnitrat-Elektrolyse: Bei dieser Methode wird Natriumnitrat elektrolysiert, um Salpetersäure herzustellen.
Diese Methoden unterscheiden sich hinsichtlich Wirksamkeit, Kosten und Umweltauswirkungen, und die Wahl der Methode hängt von der gewünschten Endverwendung und dem Produktionsumfang ab.
Verwendung von Salpetersäure
Salpetersäure hat ein breites Anwendungsspektrum in verschiedenen Branchen, darunter:
- Düngemittel: Salpetersäure wird bei der Herstellung von Stickstoffdüngern wie Ammoniumnitrat und Salpetersäuresalzen verwendet.
- Pharmazeutika: Salpetersäure wird als Reagenz bei der Herstellung von Pharmazeutika und anderen chemischen Zwischenprodukten verwendet.
- Sprengstoffe: Salpetersäure wird bei der Herstellung von Sprengstoffen wie Dynamit und Nitrozellulose verwendet.
- Metallverarbeitung: Salpetersäure wird zum Beizen, Reinigen und Ätzen von Metallen, einschließlich Stahl, Kupfer und Aluminium, verwendet.
- Färben und Drucken: Wird als Beizmittel in Färbe- und Druckprozessen verwendet.
- Wasseraufbereitung: Salpetersäure wird bei der Wasseraufbereitung verwendet, um den pH-Wert zu kontrollieren und Verunreinigungen zu entfernen.
- Forschung und Entwicklung: Salpetersäure wird als Laborreagenz für verschiedene chemische Reaktionen und Analysen verwendet.
Insgesamt hat Salpetersäure aufgrund ihrer sauren und oxidierenden Eigenschaften ein vielseitiges Anwendungsspektrum, was sie zu einer entscheidenden Chemikalie in verschiedenen industriellen Prozessen macht.
Fragen:
Ist Salpetersäure eine starke oder eine schwache Säure?
Ja, Salpetersäure (HNO3) gilt als starke Säure. Starke Säuren dissoziieren in Wasser vollständig und erzeugen Wasserstoffionen (H+), was bedeutet, dass sie vollständig ionisiert werden. Im Gegensatz dazu ionisieren schwache Säuren in Wasser nur teilweise, d. h. sie dissoziieren nicht vollständig.
In einer Salpetersäurelösung hat fast jedes Molekül ein Wasserstoffion abgegeben, was es zu einem starken Protonendonor macht. Infolgedessen weist Salpetersäure eine hohe Konzentration an Wasserstoffionen und einen niedrigen pH-Wert auf, der normalerweise bei etwa 1–2 liegt. Die Stärke einer Säure wird durch ihre Fähigkeit zur Abgabe von Wasserstoffionen bestimmt und Salpetersäure ist eine der stärksten Säuren in der Liste der starken Säuren.
Beachten Sie, dass Salpetersäure (HNO3) stark oxidierend wirkt und die Gefahr schwerer Verbrennungen und chemischer Reaktionen birgt. Gehen Sie vorsichtig mit Salpetersäure um und tragen Sie geeignete Schutzausrüstung.
