Phosphortrichlorid ist eine chemische Verbindung, die aus Phosphor und drei Chloratomen besteht. Es wird häufig als Reagenz bei chemischen Reaktionen und als Vorstufe für Organophosphorverbindungen verwendet.
| IUPAC-Name | Phosphortrichlorid |
| Molekularformel | PCl3 |
| CAS-Nummer | 7719-12-2 |
| Synonyme | Trichlorphosphin, Phosphorchlorid, Phosphortrichlorid, Phosphor(III)-chlorid |
| InChI | InChI=1S/Cl3P/c1-4(2)3 |
Eigenschaften von Phosphortrichlorid
Phosphortrichlorid-Formel
Die Formel für Phosphortrichlorid lautet PCl3. Es besteht aus einem Phosphoratom, das an drei Chloratome gebunden ist. Diese chemische Verbindung wird aufgrund ihrer Reaktivität und Vielseitigkeit in verschiedenen Branchen und Laboren häufig verwendet.
Molmasse von Phosphortrichlorid
Die Molmasse von Trichlorphosphin kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Phosphor hat eine Atommasse von etwa 31,0 Gramm pro Mol, während Chlor eine Atommasse von etwa 35,5 Gramm pro Mol hat. Daher beträgt die Molmasse von PCl3 etwa 137,3 Gramm pro Mol.
Siedepunkt von Phosphortrichlorid
Trichlorphosphin hat einen Siedepunkt von etwa 76,1 Grad Celsius. Das bedeutet, dass es beim Erhitzen vom flüssigen Zustand in den gasförmigen Zustand übergeht. Der Siedepunkt ist eine wichtige Eigenschaft, die bei der Handhabung und Verwendung von Trichlorphosphin in verschiedenen chemischen Reaktionen und Prozessen berücksichtigt werden muss.
Phosphortrichlorid Schmelzpunkt
Der Schmelzpunkt von Trichlorphosphin liegt bei etwa -112,7 Grad Celsius. Bei dieser Temperatur vollzieht es einen Phasenübergang von fest zu flüssig. Der Schmelzpunkt ist ein entscheidendes Merkmal zur Bestimmung des physikalischen Zustands von Trichlorphosphin unter verschiedenen Bedingungen.
Dichte von Phosphortrichlorid g/ml
Die Dichte von Trichlorphosphin beträgt etwa 1,574 Gramm pro Milliliter. Die Dichte stellt die Masse einer Substanz pro Volumeneinheit dar und gibt Aufschluss über die Kompaktheit und Schwere des Materials. Die Dichte von Trichlorphosphin wird häufig in chemischen Berechnungen und Formulierungen verwendet.
Molekulargewicht von Phosphortrichlorid
Das Molekulargewicht von Trichlorphosphin, berechnet durch Addition der Atomgewichte seiner Bestandteile, beträgt etwa 137,3 Gramm pro Mol. Das Molekulargewicht ist ein wertvoller Parameter zur Bestimmung der Stoffmenge bei chemischen Reaktionen und zur Formulierung präziser Messungen.
Struktur von Phosphortrichlorid
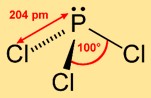
Trichlorphosphin nimmt eine trigonale Pyramidenstruktur an, wobei das Phosphoratom die Spitze einnimmt und die drei Chloratome eine dreieckige Basis bilden. Diese molekulare Anordnung trägt zu seiner chemischen Reaktivität bei und beeinflusst sein Verhalten bei verschiedenen Reaktionen.
Löslichkeit von Phosphortrichlorid
Trichlorphosphin ist in Wasser schlecht löslich, löst sich jedoch leicht in organischen Lösungsmitteln wie Benzol und Tetrachlorkohlenstoff. Die Löslichkeitseigenschaften von Trichlorphosphin sind wesentliche Überlegungen bei der Bestimmung geeigneter Lösungsmittel für seine Verwendung in verschiedenen chemischen Prozessen und Anwendungen.
| Aussehen | Farblose oder hellgelbe Flüssigkeit |
| Spezifisches Gewicht | 1.574 g/ml |
| Farbe | Farblos |
| Geruch | Acre |
| Molmasse | 137,3 g/Mol |
| Dichte | 1.574 g/ml |
| Fusionspunkt | -112,7°C |
| Siedepunkt | 76,1°C |
| Blitzpunkt | Nicht anwendbar (nicht brennbar) |
| Löslichkeit in Wasser | Reagiert mit Wasser |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Benzol und Tetrachlorkohlenstoff |
| Dampfdruck | 105 mmHg bei 25°C |
| Wasserdampfdichte | 4,83 (Luft = 1) |
| pKa | Unzutreffend |
| pH-Wert | Säure (pH < 7) |
Sicherheit und Gefahren von Phosphortrichlorid
Trichlorphosphin birgt mehrere Sicherheitsrisiken und sollte mit Vorsicht gehandhabt werden. Es wirkt stark ätzend auf Haut, Augen und Atemwege. Direkter Kontakt kann zu schweren Verbrennungen und Augenschäden führen. Das Einatmen der Dämpfe kann zu Reizungen der Atemwege und Lungenschäden führen. Darüber hinaus reagiert Trichlorphosphin heftig mit Wasser und setzt giftige Salzsäuredämpfe frei. Es ist unter bestimmten Bedingungen brennbar und der Kontakt mit Oxidationsmitteln kann zu Bränden oder Explosionen führen. Bei der Arbeit mit dieser Chemikalie sollte angemessene persönliche Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske getragen werden. Um Risiken zu minimieren, sind eine ausreichende Belüftung und Lagerung entfernt von unverträglichen Substanzen unerlässlich.
| Gefahrensymbole | Ätzend, giftig |
| Sicherheitsbeschreibung | – Verursacht schwere Hautverätzungen und Augenschäden – Gesundheitsschädlich beim Verschlucken, Einatmen oder Absorbieren – Reagiert heftig mit Wasser unter Bildung giftiger Dämpfe – Unter bestimmten Bedingungen brennbar |
| Identifikatoren der Vereinten Nationen | UN1809 |
| HS-Code | 2812.10.00 |
| Gefahrenklasse | 8 (ätzend), 6,1 (giftig) |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig |
Methoden zur Phosphortrichlorid-Synthese
Verschiedene Methoden synthetisieren Trichlorphosphin. Ein üblicher Ansatz besteht darin, den Phosphor mit überschüssigem Chlorgas zu erhitzen, was zur Bildung von Trichlorphosphin führt.
Bei einer anderen Methode wird Phosphorpentachlorid (PCl5) mit Trichlorphosphin (PCl3) erhitzt, um Trichlorphosphin herzustellen.
Bei der Reaktion zwischen Phosphoroxid (P2O5) und Salzsäure (HCl) werden die beiden Stoffe, meist mit einem Rückflusskühler, kombiniert, um die Synthese von Trichlorphosphin zu erleichtern.
Darüber hinaus führt das Erhitzen von Phosphortribromid (PBr3) mit Trichlorphosphin zur Bildung von Trichlorphosphin.
Es ist wichtig zu beachten, dass die Synthese von Trichlorphosphin unter entsprechenden Sicherheitsvorkehrungen durchgeführt werden muss, da es sich dabei um den Umgang mit reaktiven und gefährlichen Stoffen handelt. Sorgen Sie für Sicherheit während des Syntheseprozesses, indem Sie geeignete Schutzausrüstung verwenden und gut belüftete Laborbedingungen aufrechterhalten.
Insgesamt bieten diese verschiedenen Synthesemethoden unterschiedliche Ansätze zur Gewinnung von Trichlorphosphin und bieten dadurch Flexibilität bei der Herstellung für ein breites Spektrum von Industrie- und Forschungsanwendungen.
Verwendung von Phosphortrichlorid
Aufgrund seiner Vielseitigkeit und Reaktivität wird Trichlorphosphin in zahlreichen Anwendungen eingesetzt. Hier sind einige wichtige Verwendungszwecke:
- Chemisches Reagens: Es dient als wichtiges Reagens in der organischen Synthese, insbesondere bei der Herstellung von Organophosphorverbindungen. Es ist an Reaktionen wie der Vilsmeier-Haack-Reaktion und der Pudovik-Reaktion beteiligt.
- Katalysator: Trichlorphosphin fungiert als Katalysator bei verschiedenen chemischen Reaktionen, einschließlich der Synthese von Arzneimitteln, Farbstoffen und Pestiziden.
- Phosphorquelle: Es dient als Phosphorquelle bei der Herstellung von Chemikalien auf Phosphorbasis wie Phosphorsäure und Phosphoroxychlorid.
- Flammschutzmittel: Hersteller fügen Polymeren Trichlorphosphin als Flammschutzmittel hinzu, was dazu beiträgt, die Entflammbarkeit zu verringern und den Brandschutz der Materialien zu verbessern.
- Chemisches Zwischenprodukt: Verschiedene Chemikalien, darunter Pharmazeutika, Herbizide, Insektizide und Weichmacher, werden unter Verwendung von Trichlorphosphin als entscheidendem Zwischenprodukt hergestellt.
- Laborreagenz: Laboratorien verwenden Trichlorphosphin häufig als vielseitiges Reagenz für chemische Reaktionen, einschließlich der Bildung von Acylchloriden und der Umwandlung von Alkoholen in Alkylchloride.
- Wasseraufbereitung: Die starken oxidierenden und chlorierenden Eigenschaften von Trichlorphosphin machen es zu einem wertvollen Bestandteil in Wasseraufbereitungsprozessen, da es Verunreinigungen und Schadstoffe wirksam entfernt.
- Pharmazeutika: Trichlorphosphin spielt eine Rolle bei der Synthese pharmazeutischer Verbindungen, darunter Medikamente zur Behandlung von Krebs, Entzündungen und neurologischen Störungen.
- Landwirtschaftliche Anwendungen: Es findet in der Landwirtschaft Anwendung als Bestandteil bestimmter Pestizide und Herbizide und trägt so zum Pflanzenschutz und zur Unkrautbekämpfung bei.
- Kunststoffherstellung: Hersteller verwenden Trichlorphosphin bei der Herstellung von Kunststoffen und Polymeradditiven, um die Materialeigenschaften zu verbessern und sie flammhemmend zu machen.
Diese verschiedenen Anwendungen unterstreichen die Bedeutung von Trichlorphosphin in verschiedenen Branchen, in der Forschung und in täglichen Anwendungen.
Fragen:
F: Ist Phosphortrichlorid eine Base oder eine Säure?
A: Trichlorphosphin ist eine Säure.
F: Wie viele Chloratome enthält ein Molekül Phosphortrichlorid, PCl3?
A: Ein Trichlorphosphinmolekül enthält drei Chloratome.
F: Wie hoch ist die prozentuale Ausbeute einer Reaktion, bei der 200 g Phosphortrichlorid reagieren?
A: Der Ausbeuteprozentsatz kann ohne Informationen über die erhaltene Produktmenge nicht ermittelt werden.
F: Wie viele Mol sind in 15 Gramm Phosphortrichlorid enthalten?
A: In 15 Gramm sind etwa 0,116 Mol Trichlorphosphin enthalten.
F: Welche Formel stellt die binäre Molekülverbindung Phosphortrichlorid dar?
A: Die Formel PCl3 steht für Trichlorphosphin.
F: Wie lautet die Formel für Phosphortrichlorid?
A: Die Formel für Phosphortrichlorid lautet PCl3.
F: Ist Phosphortrichlorid ionisch oder kovalent?
A: Trichlorphosphin ist eine kovalente Verbindung.
F: Wie viele Chloratome enthält ein Molekül Phosphortrichlorid, PCl3?
A: Ein Trichlorphosphinmolekül enthält drei Chloratome.
F: Lewis-Struktur von Trichlorphosphin?
A: Die Lewis-Struktur von Trichlorphosphin besteht aus einem zentralen Phosphoratom, das an drei Chloratome gebunden ist, mit freien Elektronenpaaren am Phosphoratom.
F: Phosphor (P4) (s) + Chlor (g) → Trichlorphosphin (l)?
A: Die ausgeglichene Gleichung stellt die Reaktion zwischen festem Phosphor (P4) und Chlorgas (Cl2) unter Bildung von flüssigem PCl3 dar.
F: Welche Form hat Phosphortrichlorid?
A: Trichlorphosphin hat aufgrund des Vorhandenseins eines Paares freier Elektronen am Phosphoratom eine trigonale Pyramidenform.
F: Ist Phosphortrichlorid eine ionische Verbindung?
A: Nein, Trichlorphosphin ist keine ionische Verbindung; es ist eine kovalente Verbindung.
F: Hat Phosphortrichlorid Reflexionsebenen?
A: Nein, Trichlorphosphin hat keine Reflexionsebenen.
