Phosphorsäure (H3PO4) ist eine farb- und geruchlose Mineralsäure. Es wird häufig in der Lebensmittel- und Getränkeindustrie als Aromastoff und als Rostschutzmittel in der Automobilindustrie eingesetzt.
| IUPAC-Name | Phosphorsäure |
| Molekularformel | H3PO4 |
| CAS-Nummer | 7664-38-2 |
| Synonyme | Orthophosphorsäure, Trihydroxydooxydophosphor, Phosphorsäure (V), Orthophosphorsäure, klare Phosphorsäuretechnologie, Phosphorsäure |
| InChI | InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
Eigenschaften von Phosphorsäure
Molmasse von Phosphorsäure
Die Molmasse von Phosphorsäure beträgt 98,00 g/mol. Dieser Wert wird berechnet, indem die Atommassen jedes einzelnen Atoms des Moleküls addiert werden, bei dem es sich um ein Phosphoratom und drei Sauerstoffatome handelt. Die Molmasse ist eine wichtige Eigenschaft einer Verbindung, da sie zur Berechnung der in einer bestimmten Probe vorhandenen Substanzmenge mithilfe der Avogadro-Zahl verwendet wird. Darüber hinaus wird die Molmasse der Phosphorsäure verwendet, um die Konzentration einer Lösung durch Titration zu bestimmen.
Phosphorsäureformel
Die chemische Formel für Phosphorsäure lautet H3PO4, was bedeutet, dass sie ein Phosphoratom, drei Wasserstoffatome und vier Sauerstoffatome enthält. Es handelt sich um eine schwache Säure, die bis zu drei Wasserstoffionen an eine Base abgeben kann. Die Formel ist wichtig, weil sie es uns ermöglicht, chemische Gleichungen zu schreiben und die Stöchiometrie chemischer Reaktionen mit Phosphorsäure zu berechnen. Darüber hinaus wird die Formel verwendet, um die Konzentration einer Phosphorsäurelösung durch Titration zu berechnen.
Siedepunkt von Phosphorsäure
Der Siedepunkt von Phosphorsäure beträgt 158 °C (316 °F) bei 1 Atmosphäre Druck. Das bedeutet, dass bei dieser Temperatur und diesem Druck die flüssige Phase der Phosphorsäure in eine Gasphase übergeht. Der Siedepunkt hängt von den in der Verbindung vorhandenen intermolekularen Kräften ab und ist im Fall von Phosphorsäure auf das Vorhandensein von Wasserstoffbrückenbindungen zwischen den Molekülen zurückzuführen. Der Siedepunkt ist eine wichtige physikalische Eigenschaft einer Verbindung, da er zur Bestimmung ihrer Flüchtigkeit verwendet wird, was in vielen industriellen Prozessen nützlich ist.
Schmelzpunkt von Phosphorsäure
Der Schmelzpunkt von Phosphorsäure beträgt 42,35 °C (108,23 °F). Dies ist die Temperatur, bei der die feste Phase der Phosphorsäure in die flüssige Phase übergeht. Der Schmelzpunkt hängt von der Stärke der in der Verbindung vorhandenen intermolekularen Kräfte ab und ist im Fall von Phosphorsäure auf das Vorhandensein von Wasserstoffbrückenbindungen zwischen den Molekülen zurückzuführen. Der Schmelzpunkt ist eine wichtige physikalische Eigenschaft einer Verbindung, da er zur Bestimmung ihrer Reinheit und zur Feststellung ihrer Identität verwendet wird.
Dichte der Phosphorsäure g/ml
Die Dichte von Phosphorsäure beträgt 1,685 g/ml bei Raumtemperatur (25 °C oder 77 °F). Dies ist die Masse der Substanz pro Volumeneinheit. Die Dichte ist eine physikalische Eigenschaft einer Substanz und wird verwendet, um das Volumen einer bestimmten Masse der Substanz oder die Masse eines bestimmten Volumens der Substanz zu berechnen. Die Dichte der Phosphorsäure ist in vielen industriellen Prozessen wichtig, darunter bei der Herstellung von Düngemitteln, Waschmitteln und Lebensmittelzusatzstoffen.
Molekulargewicht von Phosphorsäure
Das Molekulargewicht von Phosphorsäure beträgt 98,00 g/mol. Es ist die Summe der Atomgewichte aller Atome im Molekül. Das Molekulargewicht ist eine wichtige Eigenschaft einer Verbindung, da es zur Berechnung der in einer bestimmten Probe vorhandenen Substanzmenge verwendet wird. Darüber hinaus wird das Molekulargewicht der Phosphorsäure verwendet, um die Konzentration einer Lösung durch Titration zu bestimmen.
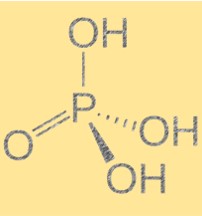
Struktur von Phosphorsäure (H3PO4)
Phosphorsäure hat die Summenformel H3PO4 und eine tetraedrische Molekülgeometrie. Es handelt sich um eine triprotische Säure, das heißt, sie kann drei Wasserstoffionen an eine Base abgeben. Das Molekül enthält ein Phosphoratom, das an vier Sauerstoffatome gebunden ist, von denen drei an Wasserstoffatome gebunden sind. Die Struktur der Phosphorsäure ist wichtig, da sie ihre chemischen und physikalischen Eigenschaften bestimmt. Das Vorhandensein von Wasserstoffbrückenbindungen zwischen Molekülen führt zu hohen Siede- und Schmelzpunkten.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1,685 bei 25°C |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 98,00 g/Mol |
| Dichte | 1,685 g/ml bei 25°C |
| Fusionspunkt | 42,35 °C (108,23 °F) |
| Siedepunkt | 158 °C (316 °F) bei 1 atm Druck |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Vollständig wasserlöslich |
| Löslichkeit | Löslich in Ethanol, Diethylether und Aceton |
| Dampfdruck | 0,0002 mmHg bei 20 °C |
| Wasserdampfdichte | 3,5 (Luft = 1) |
| pKa | pKa1=2,148, pKa2=7,198, pKa3=12,319 |
| pH-Wert | 1,0 – 2,5 (konzentrierte Lösung), 2,8 – 3,2 (verdünnte Lösung) |
H3PO4 Sicherheit und Gefahren
Phosphorsäure birgt mehrere Sicherheitsrisiken und sollte mit Vorsicht gehandhabt werden. Es kann schwere Haut- und Augenreizungen verursachen und wirkt stark korrosiv gegenüber Metallen. Direkter Kontakt mit Haut, Augen oder Schleimhäuten kann zu schweren Verbrennungen oder sogar bleibenden Schäden führen. Das Einatmen von Dämpfen kann zu Reizungen der Atemwege und Verbrennungen führen. Es sollte nicht eingenommen werden, da es schwere innere Verbrennungen und Magen-Darm-Beschwerden verursachen kann. Beim Umgang mit Phosphorsäure sollte geeignete persönliche Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske getragen werden. Es sollte außerdem an einem kühlen, trockenen Ort, fern von unverträglichen Materialien wie Oxidationsmitteln und Alkalien, gelagert werden.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | Halten Sie den Behälter fest verschlossen. Schutzhandschuhe/Schutzkleidung/Augenschutz/Gesichtsschutz tragen. |
| UN-Identifikationsnummern | UN1805 |
| HS-Code | 280920 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II (mittlere Gefahr) |
| Toxizität | Oraler LD50 (Ratte) – 1533 mg/kg |
H3PO4-Synthesemethoden
Es gibt verschiedene Methoden zur Synthese von Phosphorsäure (H3PO4).
Das gebräuchlichste Verfahren ist das Nassverfahren, bei dem Rohphosphat mit Schwefelsäure reagiert. Zur Herstellung von Calciumsulfat (Gips) und H3PO4 wird Phosphatgestein zunächst zerkleinert und anschließend mit konzentrierter Schwefelsäure vermischt. Nach dem Filtrieren der resultierenden Suspension wird das H3PO4 durch eine Reihe von Lösungsmittelextraktions- und Fällungsschritten gereinigt.
Eine weitere Methode zur Synthese von H3PO4 ist der thermische Prozess, bei dem Phosphatgestein auf eine hohe Temperatur erhitzt wird, um H3PO4 und andere Nebenprodukte wie elementaren Phosphor und Calciumoxid zu erzeugen. Aufgrund des hohen Energiebedarfs ist dieses Verfahren weniger verbreitet als das Nassverfahren.
Durch die Reaktion von Phosphorpentoxid mit Wasser entsteht H3PO4. Die Elektronik- und Halbleiterindustrie nutzt dieses Verfahren häufig zur Herstellung von hochreinem H3PO4.
Andere Methoden zur Synthese von H3PO4 umfassen die elektrochemische Oxidation von Phosphor, die Hydrolyse von Phosphortrichlorid und die Reaktion von Phosphor mit Salpetersäure . Aufgrund ihrer hohen Kosten und Komplexität sind diese Methoden weniger verbreitet als Nass- und Thermoverfahren.
Verwendung von H3PO4
Phosphorsäure ist eine vielseitige Verbindung, die in verschiedenen Branchen vielfältige Anwendung findet. Einige seiner Hauptanwendungen sind:
- Düngemittelproduktion: Hauptbestandteil der Düngemittelproduktion wie Diammoniumphosphat und Dreifachsuperphosphat.
- Lebensmittel- und Getränkeindustrie: Wird als Lebensmittelzusatzstoff und Aromastoff in verschiedenen Lebensmittel- und Getränkeprodukten wie Cola-Getränken, Marmeladen und Schmelzkäse verwendet.
- Industrielle Reinigung: Wird aufgrund seiner Fähigkeit, Rost und andere mineralische Ablagerungen aufzulösen, als Reiniger und Rostentferner im industriellen Bereich eingesetzt.
- Wasseraufbereitung: Wird zur Kontrolle des pH-Werts von Wasser in industriellen Prozessen sowie zur Entfernung von Schwermetallen und anderen Verunreinigungen verwendet.
- Arzneimittel: Wird aufgrund seiner Fähigkeit, den pH-Wert zu regulieren, bei der Herstellung von Arzneimitteln und Nahrungsergänzungsmitteln verwendet.
- Zahnheilkunde: Wird bei zahnärztlichen Eingriffen wie Wurzelkanalbehandlungen und als Bestandteil von Zahnzement verwendet.
- Metallbehandlung: Wird zur Behandlung und Passivierung von Metallen wie Edelstahl, Aluminium und Titan verwendet, um deren Korrosionsbeständigkeit zu verbessern.
- Elektronik: Wird in der Elektronikindustrie als Reinigungsmittel und als Komponente in der Halbleiterproduktion verwendet.
Fragen:
F: Wie lautet die Formel für Phosphorsäure?
A: Die Formel für Phosphorsäure lautet H3PO4.
F: Ist H3PO4 eine starke Säure?
A: Nein, H3PO4 gilt nicht als starke Säure. Es ist eine schwache Säure mit einem pKa-Wert von 2,15.
F: Ist H3PO4 eine Säure oder eine Base?
A: H3PO4 ist eine Säure, weil es beim Auflösen in Wasser ein Proton (H+) abgibt.
F: Wie ist die Lewis-Struktur für H3PO4?
A: Die Lewis-Struktur für H3PO4 ist eine tetraedrische Struktur mit einem zentralen Phosphoratom, das von vier Sauerstoffatomen umgeben ist. Jedes Sauerstoffatom geht eine Einfachbindung mit dem Phosphoratom ein, außerdem gibt es an jedem Sauerstoffatom drei Paare freier Elektronen.
F: Ist Phosphorsäure eine starke Säure? A: Nein, Phosphorsäure gilt nicht als starke Säure. Es handelt sich um eine schwache Säure mit einem pKa-Wert von 2,15 für die erste Protonenabgabe und 7,20 für die zweite Protonenabgabe.
