Phosphorpentasulfid (P2S5) ist eine Verbindung bestehend aus zwei Phosphoratomen und fünf Schwefelatomen. Es wird in verschiedenen Anwendungen eingesetzt, unter anderem bei der Herstellung von Insektiziden und Schmiermitteln.
| IUPAC-Name | Phosphorpentasulfid |
| Molekularformel | P2S5 |
| CAS-Nummer | 1314-80-3 |
| Synonyme | Phosphor(V)sulfid; Diphosphorpentasulfid; Phosphorsulfid; Pentasulfurierter Phosphor |
| InChI | InChI=1S/2P.5S |
Eigenschaften von Phosphorpentasulfid
Phosphorpentasulfid-Formel
Die Formel für Phosphorpentasulfid lautet P2S5. Es besteht aus zwei Phosphoratomen, die an fünf Schwefelatome gebunden sind.
Molmasse von Phosphorpentasulfid
Die Molmasse von Diphosphorpentasulfid kann durch Addition der Atommassen der Bestandteile berechnet werden. Die Atommasse von Phosphor (P) beträgt etwa 30,97 g/mol und die von Schwefel (S) etwa 32,07 g/mol. Die Molmasse von P2S5 beträgt daher etwa 222,27 g/mol.
Siedepunkt von Phosphorpentasulfid
Diphosphorpentasulfid hat einen Siedepunkt von etwa 514 Grad Celsius (957 Grad Fahrenheit). Bei dieser Temperatur vollzieht die Verbindung einen Phasenübergang vom flüssigen zum gasförmigen Zustand.
Phosphorpentasulfid Schmelzpunkt
Der Schmelzpunkt von Diphosphorpentasulfid liegt bei etwa 280 Grad Celsius (536 Grad Fahrenheit). Dies ist die Temperatur, bei der die Verbindung vom festen in den flüssigen Zustand übergeht.
Dichte von Phosphorpentasulfid g/ml
Die Dichte von Diphosphorpentasulfid beträgt etwa 2,02 g/ml. Dies weist darauf hin, dass die Verbindung relativ dicht ist und eine hohe Masse pro Volumeneinheit aufweist.
Molekulargewicht von Phosphorpentasulfid
Das Molekulargewicht von Diphosphorpentasulfid, das sich aus der Summe der Atomgewichte seiner Bestandteile zusammensetzt, beträgt etwa 222,27 g/mol.
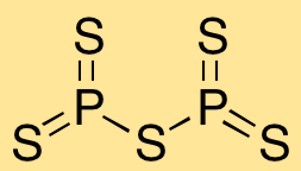
Struktur von Phosphorpentasulfid
Diphosphorpentasulfid hat eine Molekülstruktur, in der zwei Phosphoratome an fünf Schwefelatome gebunden sind. Die Anordnung der Atome bildet eine trigonale bipyramidale Form, wobei die Phosphoratome im Zentrum und die Schwefelatome sie umgeben.
Löslichkeit von Phosphorpentasulfid
Diphosphorpentasulfid ist in Wasser schlecht löslich, das heißt, es löst sich nur begrenzt auf. In organischen Lösungsmitteln wie Benzol und Schwefelkohlenstoff ist es jedoch besser löslich.
| Aussehen | Gelber Feststoff |
| Spezifisches Gewicht | 2.02 |
| Farbe | GELB |
| Geruch | Stechender Geruch |
| Molmasse | 222,27 g/Mol |
| Dichte | 2,02 g/ml |
| Fusionspunkt | 280 °C (536 °F) |
| Siedepunkt | 514 °C (957 °F) |
| Blitzpunkt | Nicht verfügbar |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Benzol und Schwefelkohlenstoff |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Nicht verfügbar |
Sicherheit und Gefahren von Phosphorpentasulfid
Diphosphorpentasulfid birgt mehrere Sicherheitsrisiken und daher ist bei der Handhabung Vorsicht geboten. Es kann bei Kontakt oder Einatmen schwere Reizungen und Verbrennungen an Haut, Augen und Atemwegen verursachen. Direkter Kontakt mit der Verbindung sollte vermieden werden und Schutzhandschuhe, Schutzbrillen und Atemschutzgeräte sollten verwendet werden. Es ist außerdem brennbar und kann sich bei Einwirkung von Hitze oder Flammen entzünden und giftige Schwefeloxide erzeugen. Eine ordnungsgemäße Lagerung fern von Zündquellen ist erforderlich. Darüber hinaus sollte Diphosphorpentasulfid nicht mit Wasser oder reaktiven Substanzen gemischt werden, da dadurch entzündliche oder giftige Gase entstehen können. Bei der Arbeit mit dieser Verbindung sind eine ordnungsgemäße Belüftung und die Einhaltung von Sicherheitsprotokollen von entscheidender Bedeutung.
| Gefahrensymbole | Entzündlich, Reizend |
| Sicherheitsbeschreibung | Verursacht schwere Hautverbrennungen und Augenschäden. Gesundheitsschädlich beim Einatmen. Brennbarer Feststoff. |
| UN-Identifikationsnummern | UN 1340 |
| HS-Code | 2812120000 |
| Gefahrenklasse | 4.2 (brennbarer Feststoff), 8 (ätzend) |
| Verpackungsgruppe | II |
| Toxizität | Giftig |
Methoden zur Synthese von Phosphorpentasulfid
Zur Synthese von Diphosphorpentasulfid können verschiedene Methoden eingesetzt werden.
Eine übliche Methode zur Synthese von Diphosphorpentasulfid besteht darin, elementaren Phosphor und Schwefel gemeinsam in einer kontrollierten Umgebung, normalerweise in einem verschlossenen Behälter, zu erhitzen. Die hohe Temperatur erleichtert die Reaktion und führt zur Bildung von Diphosphorpentasulfid.
Eine andere Methode besteht darin, Phosphortrisulfid (P4S3) mit überschüssigem Schwefel zu mischen und die Mischung zu erhitzen, um die Reaktion zu fördern. Überschüssiger Schwefel verbindet sich mit Phosphortrisulfid, was zur Bildung von Diphosphorpentasulfid führt.
Die Reaktion von Phosphorpentachlorid (PCl5) mit Schwefelwasserstoff (H2S) in Gegenwart eines geeigneten Lösungsmittels, wie beispielsweise Schwefelkohlenstoff, ermöglicht die Herstellung von Diphosphorpentasulfid. Bei der Reaktion entsteht Diphosphorpentasulfid und als Nebenprodukt wird Chlorwasserstoffgas (HCl) freigesetzt.
Bitte seien Sie bei der Verwendung dieser Synthesemethoden vorsichtig, da die beteiligten Reagenzien und Produkte gefährlich sind. Sorgen Sie während des Syntheseprozesses für angemessene Sicherheitsmaßnahmen, wie z. B. die Verwendung geeigneter Schutzausrüstung und das Arbeiten in gut belüfteten Bereichen.
Verwendung von Phosphorpentasulfid
Diphosphorpentasulfid findet aufgrund seiner einzigartigen Eigenschaften Anwendung in verschiedenen Branchen und Prozessen. Hier sind einige seiner Verwendungsmöglichkeiten:
- Herstellung von Insektiziden: Hersteller verwenden Diphosphorpentasulfid als Hauptbestandteil bei der Herstellung von Insektiziden, insbesondere von solchen, die zur Bekämpfung von Schädlingen wie Mücken und Zecken bestimmt sind.
- Schmierstoffzusatz: Unternehmen fügen Schmierstoffen Diphosphorpentasulfid als Zusatz hinzu, um deren Hochdruck- und Verschleißschutzeigenschaften zu verbessern. Dieses Additiv verbessert die Schmierleistung und schützt Maschinen unter hohen Belastungsbedingungen.
- Chemische Synthese: Diphosphorpentasulfid fungiert als Reagens bei mehreren chemischen Reaktionen, beispielsweise bei der Synthese von Thionylchlorid (SOCl2), das in der organischen Synthese weit verbreitet ist.
- Pharmazeutische Industrie: Die pharmazeutische Industrie verwendet Diphosphorpentasulfid in Forschungs- und Entwicklungsprozessen zur Synthese spezifischer Verbindungen und Zwischenprodukte.
- Metallgewinnung: Metallurgische Prozesse nutzen Diphosphorpentasulfid, um bestimmte Metalle, insbesondere Kupfer und Zink, aus ihren Erzen zu extrahieren. Es hilft bei der Entfernung von Verunreinigungen und erleichtert die Reinigung von Metallen.
- Herstellung von Farbstoffen und Pigmenten: Diphosphorpentasulfid spielt eine Rolle bei der Synthese verschiedener Farbstoffe und Pigmente und dient als Schlüsselbaustein für deren chemische Struktur.
- Chemische Kampfstoffe: In der Vergangenheit wurde Diphosphorpentasulfid zur Herstellung chemischer Kampfstoffe verwendet. Allerdings regeln und kontrollieren internationale Verträge die Verwendung für diese Zwecke streng.
Es ist wichtig zu beachten, dass aufgrund der Gefährlichkeit von Diphosphorpentasulfid bei der Handhabung, Lagerung und Entsorgung entsprechende Sicherheitsmaßnahmen und Protokolle befolgt werden müssen.
Fragen:
F: Was ist Phosphorpentasulfid-Dimer?
A: Diphosphorpentasulfid-Dimer bezieht sich auf die Molekülstruktur zweier chemisch miteinander verbundener Phosphorpentasulfid-Moleküle.
F: Wie groß ist die Entropie von Phosphorpentasulfid?
A: Die Entropie von Diphosphorpentasulfid bezieht sich auf die Messung seiner molekularen Unordnung oder Zufälligkeit bei einer bestimmten Temperatur.
F: Wie groß ist die Enthalpie von Phosphorpentasulfid?
A: Die Enthalpie von Diphosphorpentasulfid bezieht sich auf den Wärmeinhalt oder die Energieänderung, die mit seinen chemischen Reaktionen oder Umwandlungen einhergeht.
F: Was ist P2S5?
A: P2S5 ist die Summenformel für Diphosphorpentasulfid, eine Verbindung bestehend aus zwei Phosphoratomen, die an fünf Schwefelatome gebunden sind.
F: Wie viele Gramm Schwefel sind in 45,0 g P2S5 enthalten?
A: 45,0 g P2S5 enthalten etwa 28,13 g Schwefel.
F: Wie viele P2S5-Moleküle braucht man, um 222 Gramm herzustellen?
A: Ungefähr 1,54 x 10^23 Moleküle P2S5 werden benötigt, um 222 Gramm zu ergeben.
F: Wie heißt P2S5?
A: Der Name von P2S5 ist Phosphorpentasulfid.
F: Ist P2S5 ein schwacher Elektrolyt?
A: Nein, P2S5 ist kein schwacher Elektrolyt; es ist kein Elektrolyt.
F: Woher weiß ich, ob die P2S5-Partikelgröße falsch ist?
A: Eine falsche Partikelgröße von P2S5 kann durch Beobachtung von Abweichungen von den erwarteten physikalischen Eigenschaften und Verhaltensweisen der Verbindung bestimmt werden.
F: Was ist P2S5 ochem2?
A: „ochem2“ ist kein anerkannter Begriff oder keine anerkannte Bezeichnung für P2S5 im Bereich der organischen Chemie.
F: Wie heißt die Verbindung P2S5?
A: Die Verbindung P2S5 wird Diphosphorpentasulfid genannt.
F: Was ist P2S5 in der Chemie?
A: In der Chemie steht P2S5 für die Summenformel von Diphosphorpentasulfid, einer Verbindung, die in verschiedenen Anwendungen und chemischen Reaktionen verwendet wird.
