Phosphorpentachlorid ist eine chemische Verbindung mit der Formel PCl5. Es wird als Reagens bei verschiedenen chemischen Reaktionen verwendet. Es reagiert heftig mit Wasser und setzt dabei Chlorwasserstoffgas frei.
| IUPAC-Name | Phosphorpentachlorid |
| Molekularformel | PCl5 |
| CAS-Nummer | 10026-13-8 |
| Synonyme | Pentachlorphosphoran, Phosphor(V)-chlorid, Phosphorchlorid, Phosphor(V)-chlorid |
| InChI | InChI=1S/Cl5P/c1-6(2,3,4)5 |
Eigenschaften von Phosphorpentachlorid
Phosphorpentachlorid-Formel
Die Formel für Phosphorpentachlorid lautet PCl5. Es besteht aus einem Phosphoratom, das an fünf Chloratome gebunden ist. Die Formel gibt das Verhältnis der Atome in der Verbindung an.
Molmasse von Phosphorpentachlorid
Die Molmasse von Phosphor(V)-chlorid wird durch Addition der Atommassen aller seiner Bestandteile berechnet. Phosphor hat eine Molmasse von etwa 30,97 Gramm pro Mol und jedes Chloratom hat eine Molmasse von etwa 35,45 Gramm pro Mol. Ihre Zugabe ergibt eine Molmasse von etwa 208,24 Gramm pro Mol Phosphor(V)chlorid.
Siedepunkt von Phosphorpentachlorid
Phosphor(V)chlorid hat einen Siedepunkt von etwa 167,8 Grad Celsius. Bei dieser Temperatur vollzieht die Verbindung einen Phasenwechsel von flüssig zu gasförmig. Der Siedepunkt wird durch die in der Verbindung vorhandenen intermolekularen Kräfte beeinflusst.
Phosphorpentachlorid Schmelzpunkt
Der Schmelzpunkt von Phosphor(V)chlorid liegt bei etwa -93,6 Grad Celsius. Dies ist die Temperatur, bei der die Verbindung vom festen in den flüssigen Zustand übergeht. Der Schmelzpunkt ist eine wichtige Eigenschaft zur Bestimmung des physikalischen Verhaltens der Verbindung.
Dichte von Phosphorpentachlorid g/ml
Die Dichte von Phosphor(V)chlorid beträgt etwa 2,1 Gramm pro Milliliter. Die Dichte gibt die Masse einer Substanz pro Volumeneinheit an. Die Dichte von Phosphor(V)chlorid hilft, seine Anordnung und die Kompaktheit seiner Partikel zu verstehen.
Molekulargewicht von Phosphorpentachlorid
Das Molekulargewicht von Phosphor(V)chlorid beträgt etwa 208,24 Gramm pro Mol. Es ist die Summe der Atomgewichte aller in der Verbindung vorhandenen Atome. Das Molekulargewicht ist bei verschiedenen Berechnungen hilfreich, beispielsweise bei der Bestimmung der Stoffmenge in einer bestimmten Masse oder einem bestimmten Volumen.
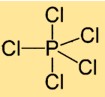
Struktur von Phosphorpentachlorid
Phosphor(V)-chlorid hat eine Molekülstruktur, bei der ein Phosphoratom von fünf Chloratomen umgeben ist. Die Chloratome sind symmetrisch um das zentrale Phosphoratom angeordnet und bilden eine trigonal-bipyramidale Geometrie.
Löslichkeit von Phosphorpentachlorid
Phosphor(V)chlorid ist in Wasser schlecht löslich. Es reagiert heftig mit Wasser und setzt dabei Chlorwasserstoffgas frei. Es löst sich jedoch leicht in polaren Lösungsmitteln wie Benzol und Tetrachlorkohlenstoff. Die Löslichkeit von Phosphor(V)chlorid wird durch die Polarität und die chemischen Eigenschaften des Lösungsmittels beeinflusst.
| Aussehen | Farblose Kristalle |
| Spezifisches Gewicht | 2,1 g/ml |
| Farbe | Farblos |
| Geruch | Acre |
| Molmasse | 208,24 g/Mol |
| Dichte | 2,1 g/ml |
| Fusionspunkt | -93,6°C |
| Siedepunkt | 167,8°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert heftig |
| Löslichkeit | Löslich in polaren Lösungsmitteln wie Benzol und Tetrachlorkohlenstoff |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Phosphorpentachlorid
Phosphor(V)chlorid birgt mehrere Sicherheitsrisiken. Es ist ätzend und kann bei Kontakt schwere Verätzungen der Haut, Augen und Atemwege verursachen. Das Einatmen seiner Dämpfe oder Stäube kann zu Reizungen und Atemwegsschäden führen. Die Verbindung reagiert heftig mit Wasser und setzt giftiges Chlorwasserstoffgas frei. Außerdem reagiert es sehr reaktiv mit organischen Materialien und kann möglicherweise Brände oder Explosionen verursachen. Beim Umgang mit Phosphor(V)chlorid sollten entsprechende Vorsichtsmaßnahmen getroffen werden, einschließlich der Verwendung von Schutzausrüstung wie Handschuhen, Schutzbrillen und Atemschutzmasken. Um Unfälle zu vermeiden und Risiken zu minimieren, sollte es an einem gut belüfteten Ort und fern von unverträglichen Substanzen gelagert und gehandhabt werden.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | Mit Anzahlung umgehen. Verwenden Sie geeignete Schutzausrüstung. |
| UN-Identifikationsnummern | UN1806 |
| HS-Code | 2812.20.00 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II (Mäßige Gefahr) |
| Toxizität | Giftig beim Verschlucken oder Einatmen. Kann schwere Reizungen verursachen. |
Methoden zur Synthese von Phosphorpentachlorid
Verschiedene Methoden ermöglichen die Synthese von Phosphor(V)chlorid. Eine übliche Methode beinhaltet die Reaktion zwischen Phosphortrichlorid (PCl3) und Chlorgas (Cl2) . Bei diesem Prozess werden im Reaktionsgefäß beide Verbindungen kombiniert und Wärme oder ein Katalysator wie Eisen initiiert die Reaktion. Chlorgas fungiert als Oxidationsmittel und wandelt PCl3 in PCl5 um. Die Reaktion läuft wie folgt ab:
PCl3 + Cl2 → PCl5
Eine weitere Methode zur Synthese von Phosphor(V)-chlorid beinhaltet die Reaktion zwischen Phosphor und Chlorgas . Diese Methode ist direkter und beinhaltet die folgende Reaktion:
P4 + 10Cl2 → 4PCl5
Bei dieser Reaktion reagieren Phosphor und Chlorgas unter geeigneten Bedingungen, was zur Bildung von Phosphor(V)-chlorid führt.
Es ist wichtig zu beachten, dass beide Synthesemethoden eine sorgfältige Handhabung und entsprechende Sicherheitsvorkehrungen erfordern. Da bei den Reaktionen hochreaktive und ätzende Stoffe beteiligt sind, sind Schutzausrüstung und ausreichende Belüftung erforderlich. Darüber hinaus ist es wichtig, diese Reaktionen in einer kontrollierten Umgebung durchzuführen, um Unfälle zu verhindern und die Sicherheit des beteiligten Personals zu gewährleisten.
Verwendung von Phosphorpentachlorid
Phosphor(V)chlorid findet aufgrund seiner einzigartigen Eigenschaften und Reaktivität vielfältige Anwendungen. Hier sind einige seiner Verwendungsmöglichkeiten:
- Chemische Synthese: In der organischen Synthese wird häufig Phosphor(V)chlorid als Reagens zur Umwandlung von Carbonsäuren in Säurechloride und Alkoholen in Alkylchloride verwendet.
- Pharmazeutika: Die Synthese pharmazeutischer Verbindungen, einschließlich Antibiotika und Farbstoffe, ist in hohem Maße auf Phosphor(V)chlorid als Schlüsselzwischenprodukt angewiesen.
- Katalysator: Phosphor(V)-chlorid katalysiert mehrere chemische Reaktionen, wie z. B. die Friedel-Crafts-Acylierung und die Beckmann-Umlagerung.
- Polymerindustrie: Bei der Herstellung verschiedener Polymere, darunter Polyvinylchlorid (PVC) und Polycarbonate, wird Phosphor(V)chlorid als Chlorierungsmittel verwendet.
- Laboranwendungen: In Laboranwendungen fungiert Phosphor(V)chlorid als Trocknungsmittel zur Entfernung von Wasserspuren aus Laborgeräten und als Chlorierungs- und Dehydratisierungsmittel bei verschiedenen Reaktionen.
- Herbizide und Pestizide: Bei der Herstellung von Herbiziden und Pestiziden zur Bekämpfung des Unkrautwachstums und zur Beseitigung von Schädlingen kommt Phosphor(V)-chlorid zum Einsatz.
- Chemische Kampfstoffe: In der Vergangenheit trug Phosphor(V)chlorid aktiv zur Herstellung chemischer Kampfstoffe bei, doch seine Verwendung für solche Zwecke unterliegt heute strengen Vorschriften und Beschränkungen.
- Metalloberflächenbehandlung: Bei der Metalloberflächenbehandlung wird Phosphor (V)-chlorid verwendet, um die Haftungseigenschaften zu verbessern und die Korrosionsbeständigkeit zu fördern.
- Flammschutzmittel: Bei der Herstellung flammhemmender Additive für Textilien, Kunststoffe und andere Materialien wird Phosphor(V)-chlorid eingesetzt.
- Pharmazeutische Herstellung: Phosphor(V)-chlorid findet Anwendung bei der Herstellung verschiedener pharmazeutischer Produkte, einschließlich der Synthese von Vitaminen und Hormonderivaten.
Aufgrund seiner ätzenden Natur und potenziellen Gesundheitsrisiken ist es wichtig, vorsichtig mit Phosphor(V)chlorid umzugehen und die entsprechenden Sicherheitsprotokolle zu befolgen.
Fragen:
F: Wie lautet die richtige Formel für Phosphorpentachlorid?
A: Die korrekte Formel für Phosphor(V)chlorid ist PCl5.
F: Wie lautet die Summenformel von Phosphorpentachlorid?
A: Die Summenformel für Phosphor(V)-chlorid lautet PCl5.
F: Welche Masse an Phosphorpentachlorid würde bei der vollständigen Reaktion von 15,2 g P4 entstehen?
A: Die produzierte Masse an Phosphor(V)chlorid würde etwa 208,24 g betragen.
F: Welche Form hat Phosphorpentachlorid?
A: Die Form von Phosphor(V)chlorid ist trigonal-bipyramidal.
F: Wie groß ist die Masse eines Moleküls Phosphorpentachlorid?
A: Die Masse eines Moleküls Phosphor(V)chlorid beträgt etwa 208,24 Gramm pro Mol.
F: Eigenschaften von Phosphorpentachlorid?
A: Phosphor(V)-chlorid ist ätzend, reagiert heftig mit Wasser und wird als Reagens in der chemischen Synthese verwendet.
F: Bindungswinkel von Phosphor(V)-chlorid?
A: Die Bindungswinkel in Phosphorpentachlorid betragen etwa 120 Grad (zwischen äquatorialen Chloratomen) und 90 Grad (zwischen axialen Chloratomen).
F: Wie stellt man Phosphorpentachlorid her?
A: Phosphor (V)-chlorid kann durch Reaktion von Phosphortrichlorid (PCl3) mit Chlorgas (Cl2) oder durch direkte Reaktion zwischen Phosphor und Chlorgas hergestellt werden.
F: Wie ist die elektronische Geometrie von Phosphor in Phosphorpentachlorid?
A: Die elektronische Geometrie von Phosphor in Phosphor(V)chlorid ist trigonal-bipyramidal.
