Phosphoroxid (P2O5) ist eine chemische Verbindung. Es entsteht aus der Verbindung von zwei Phosphoratomen und fünf Sauerstoffatomen.
| Name der IUPAC | Phosphorpentoxid |
| Molekularformel | P2O5 |
| CAS-Nummer | 1314-56-3 |
| Synonyme | Phosphorsäureanhydrid, Phosphor(V)oxid, Diphosphorpentoxid |
| InChI | InChI=1S/2O.P2/c2*1-3-2 |
Eigenschaften von Phosphoroxid
Phosphoroxid-Formel
Die Formel für Diphosphorpentoxid lautet P2O5. Es besteht aus zwei Phosphoratomen und fünf Sauerstoffatomen. Diese chemische Formel gibt das Verhältnis der Elemente in der Verbindung an.
Molmasse von Phosphoroxid
Die Molmasse von Diphosphorpentoxid (P2O5) wird durch Addition der Atommassen seiner Bestandteile berechnet. Phosphor hat eine Atommasse von etwa 31,0 Gramm pro Mol, während Sauerstoff eine Atommasse von etwa 16,0 Gramm pro Mol hat. Die Molmasse von P2O5 beträgt daher etwa 141,9 Gramm pro Mol.
Siedepunkt von Phosphoroxid
Diphosphorpentoxid hat keinen bestimmten Siedepunkt. Stattdessen geht es beim Erhitzen eine chemische Reaktion ein, die sich in Phosphorsäure (H3PO4) umwandelt und dabei Wärme freisetzt. Daher hat es keinen genau definierten Siedepunkt wie viele andere Verbindungen.
Schmelzpunkt von Phosphoroxid
Diphosphorpentoxid (P2O5) hat einen Schmelzpunkt von etwa 340 Grad Celsius (644 Grad Fahrenheit). Bei dieser Temperatur geht die feste Verbindung in den flüssigen Zustand über. Es ist wichtig zu beachten, dass Diphosphorpentoxid stark hygroskopisch ist, was bedeutet, dass es leicht Feuchtigkeit aus der Luft aufnimmt.
Phosphoroxiddichte g/ml
Die Dichte von Diphosphorpentoxid beträgt etwa 2,39 Gramm pro Milliliter (g/ml). Die Dichte ist ein Maß für die Masse pro Volumeneinheit und dieser Wert gibt an, wie schwer oder kompakt die Substanz ist. Die Dichte von Diphosphorpentoxid trägt zu seinen physikalischen Eigenschaften und seinem Verhalten in verschiedenen Anwendungen bei.
Molekulargewicht von Phosphoroxid
Das Molekulargewicht von Diphosphorpentoxid (P2O5) beträgt etwa 141,9 Gramm pro Mol. Dieser Wert stellt die Summe der Atommassen von Phosphor und Sauerstoff in der Verbindung dar. Das Molekulargewicht wird häufig bei Berechnungen verwendet, die chemische Reaktionen und die Stöchiometrie von Verbindungen betreffen.
Struktur von Phosphoroxid
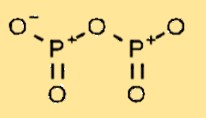
Diphosphorpentoxid hat eine Molekülstruktur, die aus zwei Phosphoratomen besteht, die an fünf Sauerstoffatome gebunden sind. Die Anordnung der Atome bildet eine zyklische Struktur, wobei jedes Phosphoratom an zwei Sauerstoffatome gebunden ist und eine Doppelbindung mit dem benachbarten Phosphoratom teilt.
Löslichkeit von Phosphoroxid
Diphosphorpentoxid ist in Wasser nicht löslich. Es reagiert heftig mit Wasser unter Bildung von Phosphorsäure und setzt dabei Wärme frei. Es ist jedoch in einigen organischen Lösungsmitteln wie Schwefelkohlenstoff und Chloroform löslich. Die Löslichkeitseigenschaften von Diphosphorpentoxid spielen eine Rolle bei seiner chemischen Reaktivität und seinen Anwendungen.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,39 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 141,9 g/Mol |
| Dichte | 2,39 g/ml |
| Fusionspunkt | 340 °C (644 °F) |
| Siedepunkt | Reagiert unter Bildung von Phosphorsäure |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert mit Wasser unter Bildung von Phosphorsäure |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Schwefelkohlenstoff, Chloroform |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Phosphoroxid
Diphosphorpentoxid (P2O5) birgt einige Sicherheitsrisiken und daher ist beim Umgang damit Vorsicht geboten. Es reagiert heftig mit Wasser, setzt Wärme frei und bildet Phosphorsäure, die zu Verbrennungen und Reizungen der Haut, Augen und Atemwege führen kann. Bei der Arbeit mit Diphosphorpentoxid ist es wichtig, den Kontakt mit dem Stoff zu vermeiden und geeignete Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske zu tragen. Darüber hinaus ist es wichtig, die Masse in einem dicht verschlossenen Behälter, fern von Feuchtigkeit und unverträglichen Materialien, aufzubewahren. Um eine Ansammlung von Dämpfen zu verhindern, muss für eine ausreichende Belüftung gesorgt werden.
| Gefahrensymbole | Ätzend, schädlich |
| Sicherheitsbeschreibung | – Verursacht schwere Hautverätzungen und Augenschäden – Kann bei Verschlucken oder Einatmen gesundheitsschädlich sein – Reagiert heftig mit Wasser – Von Feuchtigkeit und unverträglichen Materialien fernhalten |
| UN-Identifikationsnummern | Ein 1807 |
| HS-Code | 2819.10.90 |
| Gefahrenklasse | Klasse 8 (ätzende Stoffe) |
| Verpackungsgruppe | PG II (mittlere Gefahr) |
| Toxizität | Giftig für Wasserorganismen, kann in Gewässern langfristig schädliche Auswirkungen haben |
Methoden zur Phosphoroxid-Synthese
Zur Synthese von Diphosphorpentoxid (P2O5) stehen verschiedene Methoden zur Verfügung.
Eine übliche Methode besteht darin, Phosphor in Gegenwart von überschüssigem Sauerstoff zu verbrennen. Bei dieser Reaktion entsteht Phosphorpentoxid in Form eines weißen festen Rückstands. Die Gleichung für diesen Prozess lautet P4 + 5O2 → 2P2O5.
Eine andere Methode beinhaltet die kontrollierte Oxidation von Phosphorverbindungen wie Phosphortrichlorid (PCl3) oder Phosphortribromid (PBr3) mit Sauerstoff oder Luft. Die Reaktion findet normalerweise bei hohen Temperaturen statt und das resultierende Produkt ist Phosphorpentoxid.
Um Diphosphorpentoxid zu erhalten, kann Phosphorsäure (H3PO4) durch Erhitzen auf hohe Temperaturen dehydriert werden. Dieser Prozess entfernt Wassermoleküle und führt zur Bildung von Phosphorpentoxid.
Eine andere Methode zur Herstellung von Diphosphorpentoxid beinhaltet die thermische Zersetzung bestimmter Phosphatsalze. Beispielsweise führt das Erhitzen von Ammoniumdihydrogenphosphat (NH4H2PO4) oder Ammoniumphosphat ((NH4)3PO4) zur Bildung von Phosphorpentoxid.
Bei der Synthese von Diphosphorpentoxid ist aufgrund seiner Reaktivität und der Wärmeentwicklung bei bestimmten Reaktionen Vorsicht geboten. Es sollten angemessene Sicherheitsvorkehrungen befolgt werden, wie z. B. das Arbeiten in einem gut belüfteten Bereich und das Tragen geeigneter Schutzausrüstung.
Diese Synthesemethoden bieten Möglichkeiten zur Gewinnung von Diphosphorpentoxid, das in verschiedenen Bereichen Anwendung findet, darunter bei der Herstellung von Phosphorsäure, Düngemitteln und chemischen Zwischenprodukten.
Verwendung von Phosphoroxid
Diphosphorpentoxid (P2O5) findet aufgrund seiner einzigartigen Eigenschaften vielfältige Anwendungen in verschiedenen Branchen. Hier sind einige häufige Anwendungen von Diphosphorpentoxid:
- Herstellung von Phosphorsäure: Bei der Herstellung von Phosphorsäure wird häufig Diphosphorpentoxid als wichtiger Vorläufer verwendet. Phosphorsäure findet vielfältige Anwendung in Düngemitteln, Lebensmittelzusatzstoffen und Reinigungsmitteln.
- Düngemittelherstellung: Diphosphorpentoxid spielt eine wesentliche Rolle bei der Herstellung verschiedener Phosphatdünger, einschließlich Superphosphat- und Ammoniumphosphatdünger. Diese Düngemittel versorgen Pflanzen mit wichtigen Nährstoffen, um ein gesundes Wachstum zu fördern.
- Chemische Zwischenprodukte: Die Synthese verschiedener organischer Verbindungen wie Pharmazeutika, Pestizide und Flammschutzmittel bezieht sich auf Diphosphorpentoxid als chemisches Zwischenprodukt.
- Trockenmittel: Diphosphorpentoxid hat eine starke Affinität zu Wasser und wirkt als Trockenmittel. Es wird in mehreren chemischen Reaktionen verwendet, um Wasser zu entfernen und die gewünschten Reaktionen voranzutreiben.
- Katalysator: Diphosphorpentoxid fungiert als Katalysator bei bestimmten chemischen Reaktionen. Es erleichtert diese Reaktionen, indem es die Aktivierungsenergie verringert und dadurch die Reaktionsgeschwindigkeit erhöht.
- Trockenmittel: Die hygroskopische Natur von Diphosphorpentoxid macht es für den Einsatz als Trockenmittel in feuchtigkeitsempfindlichen Anwendungen geeignet. Es absorbiert und entfernt effektiv Feuchtigkeit aus der Umgebung.
- Glasherstellung: Glasformulierungen enthalten Diphosphorpentoxid, um ihre Eigenschaften, einschließlich Wärmeausdehnung und Brechungsindex, zu verändern. Spezialgläser wie optische Gläser und Borosilikatgläser nutzen es aktiv.
- Metalloberflächenbehandlung: Metalloberflächenbehandlungen wie Phosphatieren verwenden Diphosphorpentoxid, um die Korrosionsbeständigkeit zu verbessern und die Lackhaftung auf Metalloberflächen zu verbessern.
Diese vielfältigen Anwendungen unterstreichen die Bedeutung von Diphosphorpentoxid in Branchen von der Landwirtschaft bis zur Pharmaindustrie und machen es zu einer wertvollen und weithin nützlichen Verbindung.
Fragen:
F: Wie hoch ist die Oxidationszahl von Phosphor im PO-Ion?
A: Die Oxidationszahl von Phosphor im PO-Ion beträgt +5.
F: Welchen Oxidationszustand hat ein einzelnes Phosphoratom in PO43−?
A: Die Oxidationsstufe eines einzelnen Phosphoratoms in PO43− beträgt +5.
F: Wie hoch ist die Oxidationszahl von Phosphor?
A: Die Oxidationszahl von Phosphor kann variieren, liegt aber im Allgemeinen bei +3 oder +5.
F: Wie heißt die Verbindung P2O5?
A: Der Name der Verbindung P2O5 ist Phosphor (V)pentoxid.
F: Was ist P2O5?
A: P2O5 ist eine chemische Verbindung namens Phosphor(V)pentoxid.
F: Wie lautet der korrekte Name für P2O5?
A: Der korrekte Name für P2O5 ist Phosphor(V)pentoxid.
F: Wie heißt P2O5?
A: Der Name für P2O5 ist Phosphor (V)pentoxid.
F: Ist P2O5 amphoter?
A: Nein, P2O5 ist nicht amphoter. Es ist ein saures Oxid.
F: Was ist P2O5-Dünger?
A: P2O5-Dünger bezieht sich auf Düngemittel, die Phosphor (V)pentoxid (P2O5) als Phosphorquelle enthalten, was für das Pflanzenwachstum wichtig ist.
F: Ist P2O5 sauer oder basisch?
A: P2O5 ist eine saure Verbindung.
F: Ist P2O5 eine ionische Verbindung?
A: Nein, P2O5 ist eine kovalente Verbindung.
F: Wie berechnet man P2O5 in Düngemitteln?
A: Um die Menge an P2O5 in einem Dünger zu berechnen, multiplizieren Sie den Prozentsatz an P2O5 mit dem Gewicht des Düngers.
F: Eigenschaften von P2O5, löslich?
A: P2O5 ist in Wasser schlecht löslich, reagiert aber leicht mit Wasser unter Bildung von Phosphorsäure.
F: Wie viele Kilogramm P sind in 14 % P2O5 enthalten?
A: Um die Menge an Phosphor (P) in 14 % P2O5 zu berechnen, multiplizieren Sie das Gewicht des Düngers mit 0,14.
