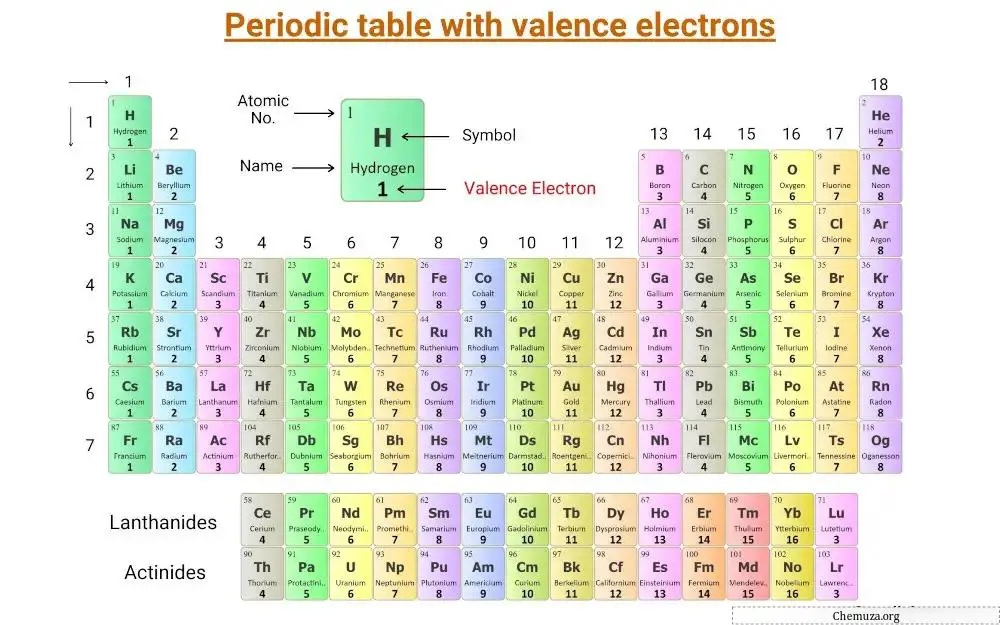
Dies ist ein Periodensystem , in dem Valenzelektronen markiert sind.
Lassen Sie uns das Konzept der Valenzelektronen zusammen mit der Anzahl der Valenzelektronen von Hauptgruppenelementen und Übergangselementen verstehen.
Was sind Valenzelektronen?
Valenzelektronen sind die Elektronen, die sich in der äußersten Schale oder im Energieniveau eines Atoms befinden und an der chemischen Bindung beteiligt sind.
Beispielsweise hat Magnesium in seiner äußersten Umlaufbahn zwei Elektronen, also zwei Valenzelektronen. [1]
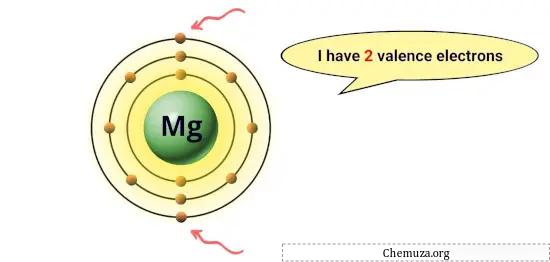
Diese Elektronen sind für die chemischen Eigenschaften eines Elements verantwortlich, beispielsweise für seine Reaktivität und die Art der chemischen Bindungen, die es mit anderen Atomen eingehen kann.
Die Anzahl der Valenzelektronen eines Atoms bestimmt seine Position im Periodensystem und seine Fähigkeit, chemische Bindungen einzugehen.
Valenzelektronen der Hauptgruppenelemente
Die Hauptgruppenelemente, auch repräsentative Elemente genannt, befinden sich in den Gruppen 1, 2 und 13 bis 18 des Periodensystems.
Die Anzahl der Valenzelektronen in diesen Elementen entspricht ihrer Gruppennummer.
Beispielsweise haben Elemente der Gruppe 1 wie Lithium und Natrium ein Valenzelektron, während Elemente der Gruppe 2 wie Magnesium und Kalzium zwei Valenzelektronen haben.
Elemente der Gruppe 13, wie Bor und Aluminium , haben drei Valenzelektronen und so weiter.
Diese Valenzelektronen sind für die einzigartigen chemischen Eigenschaften und Reaktivität der Elemente verantwortlich.
Valenzelektronen von Übergangs- und internen Übergangselementen
Die Valenzelektronen von Übergangselementen und internen Übergangselementen sind schwieriger zu bestimmen als die von Hauptgruppenelementen.
Tatsächlich sind die Unterschicht d der Übergangselemente und die Unterschicht f der inneren Übergangselemente unvollständig gefüllt und liegen sehr nahe an der äußeren Unterschicht s.
Dadurch können sich die Elektronen der d- und s-Unterschalen der Übergangselemente und der f- und s-Unterschalen der inneren Übergangselemente wie Valenzelektronen verhalten.
Bei Übergangselementen können die Valenzelektronen aufgrund des Beitrags der Elektronen der d-Unterschale und der s-Unterschale zwischen 3 und 12 liegen. In manchen Fällen werden auch Elektronen in unvollständigen d-Orbitalen als Valenzelektronen betrachtet. [2]
In ähnlicher Weise können bei internen Übergangselementen (oder f-Block-Elementen) die Valenzelektronen aufgrund des Beitrags von f-Unterschalen- und s-Unterschalen-Elektronen zwischen 3 und 16 liegen. [3] Elektronen in unvollständigen d-Orbitalen können in einigen internen Übergangsmetallen auch als Valenzelektronen betrachtet werden.
Es ist wichtig zu beachten, dass bei Übergangs- und internen Übergangselementen die Valenzelektronen die Elektronen sind, die in den Schalen außerhalb des Edelgaskerns vorhanden sind.
