Oxalsäure ist eine farb- und geruchlose organische Verbindung, die in vielen Gemüse- und Obstsorten vorkommt. Es wird in verschiedenen industriellen Prozessen wie der Metallreinigung und dem Polieren eingesetzt. Es kann auch schädlich sein, wenn es in großen Mengen eingenommen wird.
| IUPAC-Name | Ethandisäure |
| Molekularformel | C2H2O4 |
| CAS-Nummer | 144-62-7 |
| Synonyme | Ethandisäure, Zuckersäure, Oxirsäure, Holzbleiche, Sauerampfersäure, C2-Dicarbonsäure usw. |
| InChI | InChI=1S/C2H2O4/c3-1(4)2(5)6/h(H,3,4)(H,5,6) |
Eigenschaften von Oxalsäure
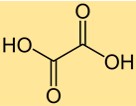
Oxalsäure-Formel
Die chemische Formel für Oxalsäure lautet C2H2O4. Es besteht aus zwei Kohlenstoffatomen, zwei Sauerstoffatomen und vier Wasserstoffatomen. Die Formel für Oxalsäure ist für viele chemische Berechnungen wichtig, beispielsweise für die Bestimmung des Molekulargewichts oder der Molzahl von Oxalsäure in einer Probe. Die Formel gibt auch Auskunft über das Verhältnis der im Molekül vorhandenen Atome.
Molmasse von Oxalsäure
Die Molmasse von Ethandisäure beträgt 90,03 g/mol. Dies wird berechnet, indem die Atommassen jedes im Molekül vorhandenen Elements addiert werden (2 Kohlenstoffatome, 2 Sauerstoffatome und 4 Wasserstoffatome). Die Molmasse von Ethandisäure ist für viele chemische Berechnungen wichtig, beispielsweise zur Bestimmung der Menge an Ethandisäure, die für eine bestimmte Reaktion benötigt wird, oder der Konzentration einer Ethandisäurelösung.
Siedepunkt von Oxalsäure
Der Siedepunkt von Ethandisäure liegt bei 365°C. Bei dieser Temperatur geht die flüssige Phase der Ethandisäure in die Dampfphase über und wird gasförmig. Der Siedepunkt von Ethandisäure wird durch verschiedene Faktoren wie Druck, Reinheit und das Vorhandensein von Verunreinigungen beeinflusst. Oxalsäure ist bei hohen Temperaturen relativ stabil, kann sich jedoch bei längerer Hitzeeinwirkung zersetzen und Kohlendioxid und Wasser bilden.
Schmelzpunkt von Oxalsäure
Der Schmelzpunkt von Ethandisäure liegt bei 189–191 °C. Dies ist die Temperatur, bei der feste Ethandisäure zu verflüssigen und flüssig zu werden beginnt. Der Schmelzpunkt von Ethandisäure kann durch verschiedene Faktoren wie Reinheit, Druck und Kristallstruktur beeinflusst werden. Der Schmelzpunkt ist eine wichtige physikalische Eigenschaft von Ethandisäure, da er dabei hilft, ihre Eignung für verschiedene Anwendungen zu bestimmen.
Dichte der Oxalsäure g/ml
Die Dichte von Ethandisäure beträgt 1,90 g/ml. Das bedeutet, dass ein Milliliter Ethandisäure 1,90 Gramm wiegt. Die Dichte von Ethandisäure kann je nach Temperatur, Druck und Konzentration der Lösung variieren. Die Dichte von Ethandisäure ist eine wichtige Eigenschaft, die in vielen chemischen und industriellen Prozessen verwendet wird, beispielsweise zur Bestimmung der Menge an Ethandisäure, die für eine Reaktion benötigt wird, oder zur Berechnung des Volumens einer Lösung.
Molekulargewicht der Oxalsäure
Das Molekulargewicht von Ethandisäure beträgt 90,03 g/mol. Es ist die Summe der Atomgewichte aller Atome im Molekül. Das Molekulargewicht von Ethandisäure wird in verschiedenen chemischen Berechnungen verwendet, beispielsweise zur Bestimmung der Molzahl Ethandisäure in einer bestimmten Probe oder der Konzentration einer Ethandisäurelösung.
Struktur von Oxalsäure
Oxalsäure hat eine Dicarbonsäurestruktur mit zwei Carboxylgruppen (-COOH), die an ein zentrales Kohlenstoffatom gebunden sind. Das Molekül hat eine planare Struktur, wobei die beiden Carboxylgruppen senkrecht ausgerichtet sind. Die Struktur der Oxalsäure macht sie zu einer starken organischen Säure, die in der Lage ist, zwei Protonen in eine Lösung abzugeben.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 1,90 g/ml bei 20 °C |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 90,03 g/Mol |
| Dichte | 1,90 g/ml bei 20 °C |
| Fusionspunkt | 189-191°C |
| Siedepunkt | 365°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 90 g/L bei 20°C |
| Löslichkeit | Löslich in Wasser, Alkohol, Ether und Glycerin |
| Dampfdruck | 0,0001 mmHg bei 25 °C |
| Wasserdampfdichte | 3,3 (Luft=1) |
| pKa | pKa1=1,25, pKa2=4,14 |
| pH-Wert | 1,2 (0,1 Mio. Lösungen) |
Sicherheit und Gefahren von Oxalsäure
Oxalsäure ist eine gefährliche Substanz, die bei unsachgemäßer Handhabung gesundheitsschädlich sein kann. Es kann ätzend auf Haut, Augen und Atemwege wirken und bei Kontakt Reizungen oder Verbrennungen verursachen. Das Einatmen von Ethandisäure-Staub oder -Dampf kann ebenfalls zu Atemwegsreizungen und Lungenschäden führen. Beim Umgang mit Ethandisäure ist es wichtig, geeignete persönliche Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske zu tragen. Darüber hinaus sollte es an einem kühlen, trockenen Ort, entfernt von Wärme- und Zündquellen, gelagert werden. Die Entsorgung von Ethandisäure sollte gemäß den örtlichen Vorschriften erfolgen.
| Gefahrensymbole | T, C |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Tragen Sie geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz. Bei Augenkontakt sofort mit reichlich Wasser spülen und einen Arzt aufsuchen. Bei Unfall oder Unwohlsein sofort einen Arzt aufsuchen (wenn möglich dieses Etikett vorzeigen). |
| AN-Kennungen | UN3261 |
| HS-Code | 291711 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | III |
| Toxizität | Oral LD50: 750 mg/kg (Ratte), dermal LD50: 1000 mg/kg (Kaninchen), inhalativ LC50: 1100 ppm/8h (Ratte) |
Oxalsäure-Synthesemethoden
Es gibt verschiedene Methoden zur Synthese von Oxalsäure (Ethandisäure), darunter die Oxidation von Kohlenhydraten, die Oxidation von Ethylenglykol und die Reaktion von Kohlenmonoxid mit Natriumhydroxid .
Eine der gebräuchlichsten Methoden ist die Oxidation von Kohlenhydraten mit Salpetersäure. Durch die Hydrolyse von Kohlenhydraten entstehen Monosaccharide, die wir dann mit Salpetersäure und einem Katalysator wie Vanadiumpentoxid oxidieren. Nachdem wir die resultierende Mischung mit Calciumcarbonat behandelt haben, behandeln wir sie mit Schwefelsäure, um Ethandisäure freizusetzen.
Eine weitere Methode zur Synthese von Ethandisäure ist die Oxidation von Ethylenglykol unter Verwendung von Salpetersäure und einem Katalysator wie Platin oder Palladium. Wir oxidieren Ethylenglykol zu Glykolsäure und oxidieren es dann mit Salpetersäure und einem Katalysator weiter zu Ethandisäure. Anschließend behandeln wir die resultierende Mischung mit Calciumcarbonat und Schwefelsäure, um Ethandisäure freizusetzen.
Eine dritte Methode zur Synthese von Ethandisäure beinhaltet die Reaktion von Kohlenmonoxid mit Natriumhydroxid in Gegenwart eines Katalysators wie Nickel oder Kobalt. Bei der Reaktion von Kohlenmonoxid mit Natriumhydroxid entsteht Natriumformiat, das wir dann mit Natriumhydroxid zu Natriumoxalat reagieren lassen. Bei der Behandlung von Natriumoxalat mit Schwefelsäure wird Ethandisäure freigesetzt.
Verwendung von Oxalsäure
Oxalsäure findet aufgrund ihrer einzigartigen chemischen Eigenschaften viele verschiedene Einsatzmöglichkeiten in verschiedenen Branchen. Hier sind einige häufige Anwendungen von Ethandisäure:
- Rostentfernung: Wird häufig als Rostentferner für Metalloberflächen wie Eisen, Stahl und Kupfer verwendet.
- Bleichmittel: Wird in der Textilindustrie zum Aufhellen von Stoffen und Fasern verwendet.
- Holzbearbeitung: Wird zum Entfernen von Flecken aus Holz verwendet, z. B. Wasserflecken oder Flecken, die durch Eisen oder andere Metalle verursacht werden.
- Reinigungsmittel: Wird als Reinigungsmittel für verschiedene Oberflächen verwendet, einschließlich Badezimmer- und Küchenarmaturen, Arbeitsplatten und Böden.
- Chelatbildner: Wird auch als Chelatbildner in verschiedenen industriellen Prozessen verwendet, einschließlich der Herstellung von Keramik und Pharmazeutika.
- Ätzmittel: Wird in der Elektronikindustrie als Ätzmittel verwendet, um Metalloxide und Verunreinigungen von Halbleiteroberflächen zu entfernen.
- Fotografie: Wird in der Fotografie als Entwicklungsmittel für bestimmte Arten von Fotofilmen verwendet.
- Medizinische Verwendung: Wird bei einigen medizinischen Behandlungen verwendet, einschließlich der Entfernung von Kalziumablagerungen aus dem Körper und der Behandlung von Harnwegsinfektionen.
Fragen:
F: Wo kann ich Oxalsäure in meiner Nähe kaufen?
A: Oxalsäure kann in vielen Baumärkten, Baumärkten und Online-Händlern gekauft werden. Möglicherweise ist es auch in Fachgeschäften für Chemiebedarf erhältlich.
F: Wie kann ich Oxalsäure in Lebensmitteln neutralisieren?
A: Oxalsäure kann in Lebensmitteln durch Zugabe einer kalziumreichen Substanz wie Milch oder Käse neutralisiert werden. Calcium bindet an Oxalsäure und verringert so deren Wirkung auf den Körper.
F: Wie hoch ist der Massenanteil an Kohlenstoff in Oxalsäure, H2C2O4?
A: Das Molekulargewicht von Oxalsäure beträgt 90,03 g/mol. Die Kohlenstoffmasse in einem Mol Ethandisäure beträgt 24,02 g. Daher beträgt der Massenanteil an Kohlenstoff in Ethandisäure (24,02 g/90,03 g) x 100 % = 26,66 %.
F: Wie kann ich die Oxalsäure im Spinat reduzieren?
A: Oxalsäure kann im Spinat reduziert werden, indem man den Spinat vor dem Verzehr blanchiert. Bei diesem Verfahren wird Spinat kurz gekocht und anschließend in Eiswasser abgekühlt, um den Ethandisäuregehalt zu reduzieren.
F: Wie hoch ist der Massenanteil an Kohlenstoff in Oxalsäure, H2C2O4?
A: Das Molekulargewicht von Oxalsäure beträgt 90,03 g/mol. Die Kohlenstoffmasse in einem Mol Ethandisäure beträgt 24,02 g. Daher beträgt der Massenanteil an Kohlenstoff in Ethandisäure (24,02 g/90,03 g) x 100 % = 26,66 %.
F: Ist H2C2O4 eine Säure oder eine Base?
A: H2C2O4 ist eine Säure, auch Ethandisäure genannt.
F: Wie ist die Reaktionsreihenfolge von H2C2O4? A: Die Reihenfolge der Reaktion von H2C2O4 hängt von der jeweiligen Reaktion ab. Sie kann experimentell mit Methoden wie der Anfangsgeschwindigkeitsmethode oder den integrierten Geschwindigkeitsgesetzen bestimmt werden.
