Nickel(II)-oxid ist eine chemische Verbindung mit der Formel NiO. Es ist ein schwarzer Feststoff, der häufig als Katalysator und bei der Herstellung von Keramik und Pigmenten verwendet wird.
| IUPAC-Name | Nickel(II)-oxid |
| Molekularformel | NiO |
| CAS-Nummer | 1313-99-1 |
| Synonyme | Nickeloxid, Nickelmonoxid, Ni(II)-oxid |
| InChI | InChI=1S/Ni.O |
Eigenschaften von Nickel(II)-oxid
Nickel(II)-Oxid-Formel
Die chemische Formel für Nickelmonoxid lautet NiO. Es besteht aus einem Nickelatom (Ni) und einem Sauerstoffatom (O), was zu einer einfachen und unkomplizierten Formel führt.
Molmasse von Nickel(II)-oxid
Die Molmasse von Nickelmonoxid kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Für NiO beträgt die Molmasse etwa 74,69 Gramm pro Mol (g/mol).
Siedepunkt von Nickel(II)-oxid
Nickelmonoxid hat keinen eindeutigen Siedepunkt, da es vor Erreichen seines Siedepunkts zersetzt wird. Beim Erhitzen zerfällt es in seine Bestandteile Nickel und Sauerstoff.
Nickel(II)-oxid Schmelzpunkt
Der Schmelzpunkt von Nickelmonoxid liegt bei etwa 1984 Grad Celsius (1984 °C). Bei dieser Temperatur geht festes NiO in einen flüssigen Zustand über.
Dichte von Nickel(II)-oxid g/ml
Die Dichte von Nickelmonoxid beträgt etwa 6,67 Gramm pro Milliliter (g/ml). Dieser Wert gibt an, wie viel Masse in ein bestimmtes Volumen gepackt ist, und ist somit ein Maß für die Kompaktheit des Stoffes.
Molekulargewicht von Nickel(II)-oxid
Das Molekulargewicht von Nickelmonoxid wird durch Addition der Atomgewichte seiner Bestandteile berechnet. Für NiO beträgt das Molekulargewicht etwa 74,69 Gramm pro Mol (g/mol).
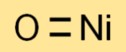
Struktur von Nickel(II)-oxid
Nickelmonoxid hat eine kubische Kristallstruktur. Es besteht aus Nickelionen (Ni2+) und Oxidionen (O2-), die in einem regelmäßigen, sich wiederholenden Muster angeordnet sind. Diese Struktur trägt zu seinen charakteristischen Eigenschaften und seinem Verhalten bei.
Löslichkeit von Nickel(II)-oxid
Nickelmonoxid ist in Wasser schlecht löslich. Es hat eine begrenzte Löslichkeit, das heißt, es löst sich nur in geringem Maße in Wasser. Es kann jedoch mit Säuren reagieren und lösliche Nickelsalze bilden, die ein gewisses Maß an chemischer Reaktivität aufweisen.
| Aussehen | Tiefes Schwarz |
| Spezifisches Gewicht | 6,67 g/ml |
| Farbe | Schwarz |
| Geruch | Geruchlos |
| Molmasse | 74,69 g/Mol |
| Dichte | 6,67 g/ml |
| Fusionspunkt | 1984°C |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löslich in Säuren, bildet lösliche Nickelsalze |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Unzutreffend |
| pH-Wert | Neutral |
Bitte beachten Sie, dass einige Eigenschaften wie Flammpunkt, Dampfdruck und pKa für Nickelmonoxid nicht anwendbar oder verfügbar sind.
Sicherheit und Gefahren von Nickel(ii)oxid
Nickelmonoxid birgt bestimmte Sicherheitsaspekte und Gefahren. Es ist wichtig, vorsichtig damit umzugehen. Direkter Kontakt mit der Haut, den Augen oder das Einatmen von Staub oder Dämpfen sollte vermieden werden. Dies kann bei manchen Menschen zu Hautreizungen und allergischen Reaktionen führen. Bei Verschlucken oder Einatmen ist sofortige ärztliche Hilfe erforderlich. Nickelmonoxid gilt nicht als leicht entflammbar, kann jedoch zu einem Brand führen, wenn es mit brennbaren Materialien in Berührung kommt. Es ist wichtig, es an einem gut belüfteten Ort aufzubewahren und zu handhaben. Bei der Arbeit mit Nickelmonoxid sollte geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden, um mögliche Risiken zu minimieren.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Mit Vorsicht behandeln. Vermeiden Sie direkten Kontakt und Einatmen. Verwenden Sie geeignete Schutzausrüstung. Bei Bedarf einen Arzt aufsuchen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2825.70.10 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Nicht klassifiziert |
| Toxizität | Gilt als gesundheitsschädlich, wenn es verschluckt oder eingeatmet wird. Kann Hautreizungen und allergische Reaktionen hervorrufen. |
Bitte beachten Sie, dass Nickelmonoxid keine spezifischen Gefahrensymbole, UN-Kennzeichnungen, Gefahrenklassen oder Verpackungsgruppen trägt. Die bereitgestellten Sicherheitsinformationen basieren auf allgemeinen Kenntnissen und Vorsichtsmaßnahmen im Zusammenhang mit der Handhabung und Verwendung von Nickelmonoxid. Für genaue und detaillierte Informationen ist es wichtig, spezifische Sicherheitsdatenblätter (SDB) zu Rate zu ziehen und die empfohlenen Sicherheitspraktiken zu befolgen.
Methoden zur Synthese von Nickel(ii)oxid
Es gibt verschiedene Methoden zur Synthese von Nickelmonoxid. Ein gängiger Ansatz ist die thermische Zersetzung von Nickelverbindungen wie Nickelcarbonat oder Nickelhydroxid. Bei dieser Methode wird eine bestimmte Vorläuferverbindung in Abwesenheit von Sauerstoff erhitzt, um Nickelmonoxid zu bilden.
Eine andere Methode beinhaltet die Oxidation von metallischem Nickel. Metallisches Nickel kann bei hohen Temperaturen mit Sauerstoff oder Luft reagieren und Nickelmonoxid bilden. Führen Sie diesen Prozess durch, indem Sie Nickelmetall in einer Luft- oder Sauerstoffatmosphäre kalzinieren oder rösten, um Nickelmonoxid herzustellen.
Verwenden Sie Fällungsreaktionen, um Nickelmonoxid zu synthetisieren, indem Sie Nickelsalze wie Nickelchlorid oder Nickelnitrat mit einer alkalischen Lösung wie Natriumhydroxid oder Ammoniumhydroxid umsetzen. Bei dieser Reaktion entsteht ein Niederschlag von Nickelmonoxid.
Die Sol-Gel-Synthese ist eine weitere praktikable Methode. Dabei handelt es sich um die Hydrolyse und Kondensation geeigneter Nickelvorläufer, beispielsweise Nickelalkoxide, in einer Lösung. Gewinnen Sie Nickelmonoxid, indem Sie das bei der Fällungsreaktion gebildete Gel trocknen und kalzinieren.
Verwenden Sie Elektroabscheidungstechniken für die Synthese von Nickelmonoxid. Durch Anlegen eines elektrischen Stroms an eine in eine Elektrolytlösung getauchte Nickelelektrode kann sich Nickelmonoxid auf der Oberfläche der Elektrode bilden.
Bei der Auswahl einer Synthesemethode sollten Faktoren wie gewünschte Reinheit, Skalierbarkeit und spezifische Anwendungsanforderungen berücksichtigt werden, da jede Methode ihre eigenen Vorteile bietet.
Verwendung von Nickel(ii)oxid
Aufgrund seiner einzigartigen Eigenschaften findet Nickelmonoxid in verschiedenen Branchen vielfältige Verwendung. Hier sind einige seiner häufigsten Anwendungen:
- Katalysator: Nickelmonoxid katalysiert aktiv verschiedene chemische Reaktionen wie Hydrierungs- und Oxidationsprozesse und erleichtert so die Umwandlung von Reaktanten in gewünschte Produkte.
- Keramik: Bei der Herstellung keramischer Materialien fungiert Nickelmonoxid aktiv als Farbstoff und trägt aktiv zur Erzielung spezifischer Farben und Muster in keramischen Glasuren und Pigmenten bei.
- Batterien: Wiederaufladbare Nickel-Cadmium- (NiCd) und Nickel-Metallhydrid- (NiMH) Batterien nutzen aktiv Nickelmonoxid als positives Elektrodenmaterial und ermöglichen so aktiv die Speicherung und Freisetzung elektrischer Energie.
- Gassensoren: Nickelmonoxid erkennt aktiv Gase wie Kohlenmonoxid (CO) und Stickstoffdioxid (NO2) in Gasdetektionsanwendungen, wenn es in darauf basierenden Sensoren verwendet wird.
- Glasherstellung: Die Glasindustrie verwendet aktiv Nickelmonoxid, um Glasprodukten verschiedene Farben zu verleihen und trägt so aktiv zur Produktion von farbigem Glas bei, einschließlich Grün-, Braun- und Schwarztönen.
- Leitfähige Beschichtungen: Nickelmonoxid fungiert aktiv als Bestandteil leitfähiger Beschichtungen, die Materialien wie Glas oder Kunststoffe aktiv leitend machen, wenn sie darauf aufgetragen werden.
- Brennstoffzellen: Nickelmonoxid fungiert aktiv als Bestandteil von Festoxid-Brennstoffzellen (SOFCs), fungiert aktiv als Kathodenmaterial und nimmt an elektrochemischen Reaktionen innerhalb der Brennstoffzelle teil.
- Katalysatorträger: Nickelmonoxid dient aktiv als Trägermaterial für andere Katalysatoren und verbessert aktiv deren Stabilität und Leistung.
Das vielfältige Anwendungsspektrum von Nickelmonoxid unterstreicht seine Bedeutung in verschiedenen Branchen und unterstreicht seine Nützlichkeit und Vielseitigkeit.
Fragen:
F: Wie lautet die Formel für Nickel(II)-oxid?
A: Die Formel für Nickel(II)-oxid lautet NiO.
F: Welches Salz entsteht, wenn Nickel(II)-oxid mit Salpetersäure reagiert?
A: Durch die Reaktion von Nickel(II)-oxid mit Salpetersäure entsteht Nickel(II)-nitrat (Ni(NO3)2).
F: Bei welcher Spannung oxidiert Nickel(II) zu Nickel(III)?
A: Nickel(II) oxidiert bei einer Spannung von etwa +1,63 V zu Nickel(III).
F: Was passiert, wenn Ni(s) zu Nickel(II)-Ionen oxidiert wird, wie im Bild gezeigt?
A: Bei der Oxidation von Ni(s) zu Nickel(II)-Ionen gehen Elektronen verloren, was zur Bildung von Ni2+-Ionen führt.
F: Welche Massen an Nickel(II)-oxid und Aluminium sollten zur Herstellung von 13,3 g Nickel verwendet werden?
A: Die Massen an Nickel(II)-oxid und Aluminium, die zur Herstellung von 13,3 g Nickel benötigt werden, hängen von der spezifischen Reaktion und Stöchiometrie ab.
