Nickelnitrat (Ni(NO₃)₂) ist eine chemische Verbindung, die Nickel- und Nitrationen enthält. Es ist wasserlöslich und wird häufig in Katalysatoren, beim Galvanisieren und als Vorläufer für andere Nickelverbindungen verwendet.
| IUPAC-Name | Nickeldinitrat |
| Molekularformel | Ni(NO₃)₂ |
| CAS-Nummer | 13138-45-9 |
| Synonyme | Nickel(II)nitrat, Nickelnitrat, Dinitronickel, Nickelbis(nitrat) |
| InChI | InChI=1S/2NO3.Ni/c2 2-1(3)4;/q2 -1;+2 |
Eigenschaften von Nickelnitrat
Nickelnitrat-Formel
Die chemische Formel für Nickeldinitrat lautet Ni(NO₃)₂. Es handelt sich um eine Verbindung bestehend aus Nickelkationen (Ni) und Nitratanionen (NO₃). Der Index „2“ in der Formel gibt an, dass es für jedes Ni+2-Kation zwei NO3–Ionen gibt.
Molmasse von Nickelnitrat
Die Molmasse von Nickeldinitrat kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Nickel (Ni) hat eine Molmasse von etwa 58,69 g/mol, während Nitrat (NO₃) eine Molmasse von etwa 62,00 g/mol hat. Zusammengenommen beträgt die Molmasse von Nickeldinitrat etwa 182,69 g/mol.
Siedepunkt von Nickelnitrat
Der Siedepunkt von Nickeldinitrat bezeichnet die Temperatur, bei der es vom flüssigen in den gasförmigen Zustand übergeht. Der Siedepunkt von Nickeldinitrat liegt bei etwa 136,7 Grad Celsius (278,06 Grad Fahrenheit). Es ist jedoch unbedingt zu beachten, dass dieser Wert je nach Reinheit der Verbindung leicht variieren kann.
Schmelzpunkt von Nickelnitrat
Der Schmelzpunkt von Nickeldinitrat ist die Temperatur, bei der es vom festen in den flüssigen Zustand übergeht. Der Schmelzpunkt von Nickeldinitrat liegt bei etwa 56,7 Grad Celsius (134,06 Grad Fahrenheit). Ebenso wie der Siedepunkt kann auch der Schmelzpunkt durch die Reinheit der Verbindung beeinflusst werden.
Dichte von Nickelnitrat g/ml
Die Dichte von Nickeldinitrat ist ein Maß für seine Masse pro Volumeneinheit. Nickeldinitrat hat eine Dichte von etwa 1,68 g/ml. Dieser Wert gibt an, dass es dichter als Wasser ist, das eine Dichte von 1 g/ml hat.
Molekulargewicht von Nickelnitrat
Das Molekulargewicht von Nickeldinitrat ist die Summe der Atomgewichte aller in seiner chemischen Formel vorkommenden Atome. Wie bereits erwähnt, beträgt das Molekulargewicht von Nickeldinitrat etwa 182,69 g/mol.
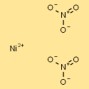
Struktur von Nickelnitrat
Die Struktur von Nickeldinitrat kann als Nickelkationen (Ni²⁺) dargestellt werden, die von zwei Nitratanionen (NO₃⁻) pro Kation umgeben sind. Nitrationen bilden koordinierte Bindungen mit Nickelkationen und bilden so eine stabile ionische Verbindung.
Löslichkeit von Nickelnitrat
Nickeldinitrat ist in Wasser sehr gut löslich und bildet eine klare grünlich-blaue Lösung. Seine Wasserlöslichkeit ist eine wesentliche Eigenschaft, da sie eine einfache Verwendung in verschiedenen Anwendungen wie Katalysatoren, Galvanisierung und der Herstellung anderer Nickelverbindungen ermöglicht.
| Aussehen | Grünlich-blauer Feststoff |
| Spezifisches Gewicht | 1,68 g/ml |
| Farbe | grünliches Blau |
| Geruch | Geruchlos |
| Molmasse | 182,69 g/Mol |
| Dichte | 1,68 g/ml |
| Fusionspunkt | 56,7°C |
| Siedepunkt | 136,7°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser und organischen Lösungsmitteln wie Ethanol |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Neutral (ca. 7) |
Bitte beachten Sie, dass einige Eigenschaften für Nickeldiitrat möglicherweise nicht verfügbar oder relevant sind.
Sicherheit und Gefahren von Nickelnitrat
Nickeldinitrat birgt einige Sicherheitsrisiken und daher ist beim Umgang damit Vorsicht geboten. Direkter Kontakt mit der Verbindung kann zu Haut- und Augenreizungen führen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. Bei der Arbeit mit Nickeldinitrat ist das Tragen geeigneter Schutzausrüstung wie Handschuhe und Schutzbrille unbedingt erforderlich. Vermeiden Sie die Einnahme, da dies gesundheitsschädlich sein kann. Im Falle einer versehentlichen Exposition suchen Sie sofort einen Arzt auf. Darüber hinaus ist die ordnungsgemäße Lagerung in einem gut belüfteten Bereich, entfernt von inkompatiblen Substanzen, von entscheidender Bedeutung, um potenzielle Risiken zu minimieren und eine sichere Handhabung zu gewährleisten.
| Gefahrensymbole | Ätzend, Reizend, Gesundheitsgefährdend |
| Sicherheitsbeschreibung | Verursacht Haut- und Augenreizungen. Gesundheitsschädlich beim Einatmen oder Verschlucken. Mit Vorsicht behandeln. Vermeiden Sie direkten Kontakt. Schutzausrüstung verwenden. |
| UN-Identifikationsnummern | UN2724 |
| HS-Code | 2834.2990 |
| Gefahrenklasse | 5.1 (Oxidierende Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Mäßig giftig |
Methoden zur Synthese von Nickelnitrat
Es gibt verschiedene Methoden zur Synthese von Nickeldinitrat. Eine übliche Methode beinhaltet die Reaktion zwischen Nickeloxid (NiO) oder Nickelhydroxid (Ni(OH)₂) mit Salpetersäure (HNO₃). Dabei löst sich Nickeloxid bzw. Nickelhydroxid in Salpetersäure auf, wodurch als Nebenprodukte Nickeldinitrat und Wasser entstehen.
Die Reaktion kann die folgende Darstellung annehmen:
- Mit Nickeloxid: NiO + 2HNO₃ → Ni(NO₃)₂ + H₂O
- Mit Nickelhydroxid: Ni(OH)₂ + 2HNO₃ → Ni(NO₃)₂ + 2H₂O
Ein anderer Ansatz beinhaltet die Reaktion zwischen metallischem Nickel und konzentrierter Salpetersäure, die zur Bildung von Nickeldinitrat und Stickstoffdioxidgas (NO₂) als Nebenprodukt führt:
- Mit Nickelmetall: Ni + 4HNO₃ → Ni(NO₃)₂ + 2H₂O + 2NO₂
Es ist wichtig, diese Reaktionen unter gut kontrollierten Bedingungen durchzuführen, da Salpetersäure ein starkes Oxidationsmittel ist und gefährlich sein kann. Sorgen Sie für ein sicheres und erfolgreiches Ergebnis während des Syntheseprozesses, indem Sie aktiv geeignete Sicherheitsmaßnahmen und Ausrüstung einsetzen. Darüber hinaus kann die Wahl der Reagenzien und Reaktionsbedingungen je nach der spezifischen Anwendung und den gewünschten Eigenschaften des Nickeldinitratprodukts variieren.
Verwendung von Nickelnitrat
Aufgrund seiner einzigartigen Eigenschaften findet Nickeldinitrat vielfältige Anwendungen in verschiedenen Branchen. Hier sind einige seiner Hauptanwendungen:
- Galvanisieren: Nickeldinitrat ermöglicht die Abscheidung einer dünnen Nickelschicht auf verschiedenen Metallen und verbessert so deren Korrosionsbeständigkeit und Aussehen während Galvanisierungsprozessen.
- Katalysator: Es spielt eine entscheidende Rolle als Katalysator bei chemischen Reaktionen und erleichtert die Umwandlung von Reaktanten in gewünschte Produkte, insbesondere in der organischen Synthese.
- Keramik: Die Keramikindustrie verwendet Nickeldinitrat, um keramischen Materialien eine spezifische Färbung zu verleihen und die Leistung zu verbessern.
- Glasindustrie: Hersteller in der Glasindustrie verwenden Nickeldinitrat, um farbiges Glas mit gewünschten optischen Eigenschaften herzustellen.
- Batterieproduktion: Hersteller verwenden Nickeldinitrat bei der Herstellung von Batterien auf Nickelbasis, einschließlich Nickel-Metallhydrid-Batterien (NiMH).
- Brennstoffzellen: Nickeldinitrat dient als Vorläufer bei der Herstellung von Nickeloxid-Elektroden für Festoxid-Brennstoffzellen (SOFCs).
- Pyrotechnik: In der Pyrotechnik dient Nickeldinitrat als Oxidationsmittel und erzeugt bei Feuerwerkskörpern grüne Flammen.
- Chemische Reagenzien: Es fungiert als Reagenz bei verschiedenen chemischen Reaktionen, insbesondere bei solchen, an denen Nickelkomplexe beteiligt sind.
- Düngemittel: In der Landwirtschaft wird Nickeldinitrat gelegentlich als Nickelquelle in Düngemitteln verwendet, um Nickelmangel in bestimmten Kulturen zu beheben.
Die vielfältigen Anwendungen von Nickeldinitrat in verschiedenen Branchen unterstreichen seine Bedeutung als vielseitige Verbindung mit vielfältigen praktischen Einsatzmöglichkeiten.
Fragen:
F: Was fällt aus, wenn Lösungen von Ammoniumphosphat und Nickel(ii)-nitrat gemischt werden?
A: Nickel(II)phosphat fällt aus.
F: Wie groß ist die Molarität einer Lösung, die 5,8 Gramm Nickelnitrat in 500 ml enthält?
A: Die Molarität beträgt 0,2 M.
F: Welche Wellenlängen absorbiert Nickelnitrat?
A: Nickeldinitrat absorbiert Wellenlängen im ultravioletten und sichtbaren Bereich.
F: Ist Nickel-II-Nitrat löslich?
A: Ja, Nickel(II)-dinitrat ist wasserlöslich.
F: Wie lautet die Formel für Nickel-II-Nitrat?
A: Die Formel lautet Ni(NO₃)₂.
F: Welche Farbe hat Nickel-II-Nitrat?
A: Die Farbe von Nickel(II)-dinitrat ist grünlich-blau.
F: Wie viele Stickstoffatome enthält die chemische Formel Ni(NO₃)₂?
A: Es gibt vier Stickstoffatome.
F: Ist Ni(NO₃)₂ in Wasser löslich?
A: Ja, Ni(NO₃)₂ ist wasserlöslich.
F: Welche der Verbindungen C4H10, BaCl2, Ni(NO₃)₂, SF6 sollten als Formeleinheiten existieren?
A: Als Formeleinheiten sollten C4H10 (Butan) und SF6 (Schwefelhexafluorid) existieren. BaCl2 und Ni(NO₃)₂ sind ionische Verbindungen.
