Nickelhydroxid (Ni(OH)2) ist eine chemische Verbindung bestehend aus Nickel- und Hydroxidionen. Es wird häufig als Vorstufe für Batterien auf Nickelbasis verwendet.
| Name der IUPAC | Nickelhydroxid |
| Molekularformel | Ni(OH)2 |
| CAS-Nummer | 12054-48-7 |
| Synonyme | Nickel(II)-hydroxid; Nickelhydroxid; Stickstoff-Nickeltrioxid (2+) |
| InChI | InChI=1S/Ni.2H2O/h;2*1H2/q+2;;/p-2 |
Eigenschaften von Nickelhydroxid
Nickelhydroxid-Formel
Die Formel für Nickelhydroxid lautet Ni(OH)2. Es besteht aus einem Nickelion (Ni) und zwei Hydroxidionen (OH-). Diese chemische Formel stellt die Zusammensetzung von Nickelhydroxid auf atomarer Ebene dar.
Molmasse von Nickelhydroxid
Die Molmasse von Ni(OH)2 wird durch Addition der Atommassen seiner Bestandteile berechnet. Nickel hat eine Atommasse von 58,6934 g/mol und jedes Hydroxidion hat eine Masse von 17,007 g/mol. Zusammengerechnet beträgt die Molmasse von Ni(OH)2 etwa 92,6934 g/mol.
Siedepunkt von Nickelhydroxid
Ni(OH)2 hat keinen genau definierten Siedepunkt, da es sich beim Erhitzen zersetzt. Bei hohen Temperaturen zersetzt es sich thermisch und wandelt sich in Nickeloxid (NiO) und Wasserdampf um.
Schmelzpunkt von Nickelhydroxid
Der Schmelzpunkt von Ni(OH)2 liegt bei etwa 230°C. Bei dieser Temperatur durchläuft Ni(OH)2 einen Phasenwechsel vom festen in den flüssigen Zustand. Die Verbindung schmilzt und ermöglicht weitere chemische Reaktionen oder Behandlungen.
Dichte von Nickelhydroxid g/ml
Die Dichte von Ni(OH)2 beträgt etwa 4,1 g/ml. Dieser Wert stellt die Masse der Verbindung pro Volumeneinheit dar. Es gibt die Kompaktheit oder Konzentration von Ni(OH)2 in einem bestimmten Raum an.
Molekulargewicht von Nickelhydroxid
Das Molekulargewicht von Ni(OH)2 wird durch Addition der Atomgewichte seiner Bestandteile bestimmt. Nickel hat ein Atomgewicht von 58,6934 g/mol und jedes Hydroxidion wiegt 17,007 g/mol. Somit beträgt das Molekulargewicht von Ni(OH)2 etwa 92,6934 g/mol.
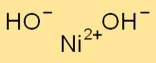
Struktur von Nickelhydroxid
Ni(OH)2 kristallisiert im hexagonalen Kristallsystem. Es bildet übereinander gestapelte Schichten aus Ni+2- und OH–Ionen. Ni+2-Ionen sind koordiniert von OH–Ionen umgeben, wodurch eine Netzwerkstruktur entsteht.
Löslichkeit von Nickelhydroxid
Ni(OH)2 ist in Wasser schlecht löslich. Es löst sich bis zu einem gewissen Grad auf und bildet aufgrund der Anwesenheit von Hydroxidionen eine leicht alkalische Lösung. Die Löslichkeit von Ni(OH)2 kann durch Faktoren wie Temperatur und pH-Wert beeinflusst werden.
| Aussehen | Einfarbig grün |
| Spezifisches Gewicht | 4,1 g/ml |
| Farbe | Grün |
| Geruch | Geruchlos |
| Molmasse | 92,6934 g/Mol |
| Dichte | 4,1 g/ml |
| Fusionspunkt | 230°C |
| Siedepunkt | Zersetzt |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | Schwach löslich |
| Löslichkeit | Unlöslich, bildet in Wasser eine alkalische Lösung |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | N / A |
| pH-Wert | Alkalisch |
Sicherheit und Gefahren von Nickelhydroxid
Ni(OH)2 birgt bestimmte Sicherheitsrisiken, die berücksichtigt werden müssen. Bei Kontakt oder Einatmen kann es zu Reizungen der Haut, der Augen und der Atemwege kommen. Eine längere oder wiederholte Exposition kann zu einer Sensibilisierung führen und allergische Reaktionen hervorrufen. Es ist wichtig, mit Ni(OH)2 vorsichtig umzugehen und geeignete Schutzmaßnahmen wie Handschuhe, Schutzbrille und Atemschutzmaske zu verwenden. Bei Verschlucken oder versehentlicher Exposition sollte sofort ein Arzt aufgesucht werden. Darüber hinaus gilt Ni(OH)2 als umweltgefährdend und muss gemäß den Vorschriften ordnungsgemäß entsorgt werden, um eine Kontamination des Bodens oder von Wasserquellen zu verhindern.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | – Kann Haut- und Augenreizungen verursachen\n- Kann Reizungen der Atemwege verursachen\n- Sensibilisierung möglich\n- Befolgen Sie die ordnungsgemäßen Handhabungs- und Entsorgungsverfahren |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2825.70.10 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Gilt als geringe bis mäßige Toxizität |
Bitte beachten Sie, dass Gefahrensymbole und UN-Kennzeichnungen nicht für Ni(OH)2 gelten, da es nicht als gefährlicher Stoff eingestuft ist. Die bereitgestellte Sicherheitsbeschreibung hebt die potenziellen Risiken und Vorsichtsmaßnahmen im Zusammenhang mit der Handhabung von Ni(OH)2 hervor. Die Toxizität von Ni(OH)2 wird allgemein als gering bis mäßig angesehen.
Methoden zur Nickelhydroxid-Synthese
Für die Herstellung von Ni(OH)2 stehen mehrere Synthesemethoden zur Verfügung. Eine übliche Methode beinhaltet die Reaktion zwischen einem löslichen Nickelsalz, wie etwa Nickelsulfat oder Nickelnitrat, und einem alkalischen Hydroxid, üblicherweise Natriumhydroxid oder Kaliumhydroxid. Die Reaktion findet in einer wässrigen Lösung unter kontrollierten Bedingungen statt, was zur Bildung von Ni(OH)2 als Niederschlag führt.
Bei der elektrochemischen Abscheidungsmethode verwendet die Elektrolysezelle metallisches Nickel als Elektrode. Durch Anlegen eines geeigneten elektrischen Stroms werden die Nickelionen aus dem Elektrolyten reduziert und in Form von Ni(OH)2 auf der Elektrode abgeschieden. Diese Methode ermöglicht eine genaue Kontrolle der Zusammensetzung und Morphologie des resultierenden Ni(OH)2.
Durch die thermische Zersetzung von Nickelsalzen entsteht Ni(OH)2. Durch Erhitzen eines Nickelsalzes wie Nickelcarbonat oder Ni(OH)2 selbst in einer kontrollierten Umgebung zersetzt sich die Verbindung und erzeugt Ni(OH)2 sowie andere Nebenprodukte.
Es ist erwähnenswert, dass die Wahl der Synthesemethode von Faktoren wie der gewünschten Reinheit, der Partikelgröße und den spezifischen Anwendungsanforderungen abhängt. Bei der Auswahl des geeigneten Synthesewegs für die Ni(OH)2-Produktion muss aufgrund der mit jeder Methode verbundenen Vorteile und Einschränkungen das gewünschte Ergebnis sorgfältig abgewogen werden.
Verwendung von Nickelhydroxid
Ni(OH)2 findet aufgrund seiner einzigartigen Eigenschaften vielfältige Anwendungen. Hier sind einige häufige Verwendungen von Ni(OH)2:
- Batterieherstellung: Ni(OH)2 spielt eine entscheidende Rolle als Kathodenmaterial in Nickel-basierten Batterien, wie z. B. Nickel-Cadmium- (NiCd) und Nickel-Metallhydrid- (NiMH) Batterien. Es speichert und gibt elektrische Energie ab und ermöglicht so eine effiziente Energiespeicherung.
- Katalysator: Ni(OH)2 fungiert als Katalysator bei verschiedenen chemischen Reaktionen, einschließlich Hydrierungs- und Oxidationsprozessen. Seine katalytischen Eigenschaften erleichtern die effiziente Umwandlung von Reaktanten in gewünschte Produkte.
- Galvanisieren: Ni(OH)2 bildet eine stabile, haftende Nickelschicht und ist daher für galvanische Anwendungen wertvoll. Es bietet eine schützende, korrosionsbeständige und ästhetisch ansprechende Beschichtung auf verschiedenen Metalloberflächen.
- Pigmente: Hersteller verwenden Ni(OH)2 als grünes Pigment bei der Herstellung von Keramik, Glas und Kunststoffen. Seine leuchtend grüne Farbe unterstreicht den ästhetischen Wert dieser Materialien.
- Gassensoren: Ni(OH)2-basierte Sensoren erkennen und überwachen Gase wie Wasserstoff, Ammoniak und Schwefelwasserstoff. Änderungen der elektrischen Leitfähigkeit in Ni(OH)2-Filmen ermöglichen die effiziente Erkennung dieser Gase.
- Wasseraufbereitung: Ni(OH)2 unterstützt Wasseraufbereitungsprozesse durch selektive Adsorption und Entfernung von Schwermetallverunreinigungen wie Blei und Cadmium. Es weist eine Affinität zu diesen Metallen auf und eignet sich daher für deren Entfernung aus Wasserquellen.
- Pharmazeutische Anwendungen: Ni(OH)2 findet Anwendung in pharmazeutischen Formulierungen und dient als Bindemittel, Sprengmittel oder pH-Regulator in Tabletten- oder Kapselformulierungen.
Dies sind nur einige Beispiele für die verschiedenen Anwendungen von Ni(OH)2, die seine Vielseitigkeit und Bedeutung in verschiedenen Branchen verdeutlichen.
Fragen:
F: Wie lautet die chemische Formel für basisches Nickel(II)-hydroxid?
A: Die chemische Formel für Nickel(II)-hydroxid lautet Ni(OH)2.
F: Ist Nickelhydroxid wasserlöslich?
A: Ni(OH)2 ist in Wasser unlöslich.
F: Wie viele Gramm Nickel(II)-chlorid werden benötigt, um 75,0 ml 0,555 M Lithiumhydroxid zu neutralisieren?
A: Die benötigten Gramm Nickelchlorid können anhand der Stöchiometrie und Molarität der Lithiumhydroxidlösung berechnet werden.
F: Welche Ladung repräsentiert Ni(OH)2?
A: Die Ladung von Ni(OH)2 ist neutral oder Null.
F: Wie berechnet man die molare Löslichkeit von Ni(OH)2?
A: Die molare Löslichkeit von Ni(OH)2 kann bestimmt werden, indem die Anzahl der Mole der gelösten Verbindung durch das Volumen der Lösung dividiert wird.
F: Was ist die ausgeglichene Form der Gleichung NaOH(aq) + NiCl2(aq) → NaCl(aq) + Ni(OH)2(s)?
A: Die ausgeglichene Gleichung lautet 2NaOH(aq) + NiCl2(aq) → 2NaCl(aq) + Ni(OH)2(s).
F: Wie viel Gramm pro Mol enthält Ni(OH)2?
A: Die Molmasse von Ni(OH)2 beträgt etwa 92,6934 g/mol.
F: Ist Ni(OH)2 wasserlöslich?
A: Nein, Ni(OH)2 ist in Wasser unlöslich.
F: Was ist das Reduktionsmittel in der Reaktion: Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2?
A: Das Reduktionsmittel in der Reaktion ist Magnesium (Mg).
F: Ist Ni(OH)2 ein Feststoff?
A: Ja, Ni(OH)2 ist eine feste Verbindung.
F: Wenn die Zelle bei 25 °C ein Potential von 0,247 V hat, wie hoch ist dann der Ksp von Ni(OH)2?
A: Der Ksp von Ni(OH)2 kann mithilfe der Nernst-Gleichung und des Zellpotentials bestimmt werden.
F: Welche Salze sind in einer sauren Lösung löslicher als in reinem Wasser?
A: Salze wie Ni(OH)2 sind in einer sauren Lösung aufgrund der Neutralisationsreaktion mit der Säure besser löslich.
