Nickelfluorid (NiF2) ist eine chemische Verbindung. Es besteht aus Nickel- und Fluoratomen. Wird aufgrund seiner einzigartigen Eigenschaften in verschiedenen Anwendungen eingesetzt, einschließlich Batterien und Galvanik.
| IUPAC-Name | Nickel(II)-fluorid |
| Molekularformel | NiF2 |
| CAS-Nummer | 10028-18-9 |
| Synonyme | Nickeldifluorid, Nickelfluorid, Difluornickel |
| InChI | InChI=1S/2FH.Ni/h2*1H;/q;;+2/p-2 |
Eigenschaften von Nickelfluorid
Nickelfluorid-Formel
Die chemische Formel für Nickeldifluorid lautet NiF2. Das bedeutet, dass jedes Nickeldifluorid-Molekül aus einem Nickelatom und zwei miteinander verbundenen Fluoratomen besteht.
Molmasse von Nickelfluorid
Nickeldifluorid hat eine Molmasse von etwa 96,69 Gramm pro Mol. Dieser Wert errechnet sich aus der Addition der Atommassen eines Nickelatoms (58,69 g/mol) und zweier Fluoratome (jeweils 18,998 g/mol).
Siedepunkt von Nickelfluorid
Der Siedepunkt von Nickeldifluorid ist relativ hoch und liegt bei etwa 1.568 Grad Celsius (2.854 Grad Fahrenheit). Diese Temperatur stellt den Punkt dar, an dem Nickeldifluorid von seiner flüssigen Phase in einen gasförmigen Zustand übergeht.
Schmelzpunkt von Nickelfluorid
Nickeldifluorid hat einen Schmelzpunkt von etwa 1.372 Grad Celsius (2.502 Grad Fahrenheit). Dies ist die Temperatur, bei der festes Nickeldifluorid flüssig wird.
Dichte von Nickelfluorid g/ml
Die Dichte von Nickeldifluorid beträgt etwa 4,72 Gramm pro Kubikzentimeter (g/cm³). Dieser Dichtewert gibt einen Überblick über die Dichte der Partikel in einem bestimmten Volumen des Stoffes.
Molekulargewicht von Nickelfluorid
Das Molekulargewicht von Nickeldifluorid beträgt etwa 96,69 Gramm pro Mol. Es wird durch Addition der Atomgewichte seiner Bestandteile in der chemischen Formel NiF2 bestimmt.
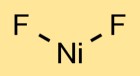
Struktur von Nickelfluorid
Nickeldifluorid hat eine kristalline Struktur. Im Zentrum befindet sich das Nickelatom, das an zwei Fluoratome gebunden ist. Durch die Anordnung der Atome entsteht ein sich wiederholendes Muster, das ein Kristallgitter bildet.
Löslichkeit von Nickelfluorid
Nickeldifluorid ist in Wasser schlecht löslich. Seine Löslichkeit wird durch Faktoren wie Temperatur und das Vorhandensein anderer Substanzen beeinflusst. Wenn es sich auflöst, zerfällt es in der wässrigen Lösung in Ni+2- und F–Ionen.
| Aussehen | Grüner kristalliner Feststoff |
| Spezifisches Gewicht | 4,72 g/cm³ |
| Farbe | Grün |
| Geruch | Geruchlos |
| Molmasse | 96,69 g/Mol |
| Dichte | 4,72 g/cm³ |
| Fusionspunkt | 1372 °C (2502 °F) |
| Siedepunkt | 1.568 °C (2.854 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löst sich in Wasser auf und zerfällt in Nickelionen und Fluoridionen |
| Dampfdruck | Nicht genau definiert |
| Wasserdampfdichte | Nicht genau definiert |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Nickelfluorid
Nickeldifluorid birgt potenzielle Sicherheitsrisiken. Bei Kontakt kann es zu Haut- und Augenreizungen kommen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. Eine längere Exposition könnte zu schwerwiegenderen gesundheitlichen Auswirkungen führen. Beim Umgang mit Nickeldifluorid sollten geeignete Schutzmaßnahmen, einschließlich Handschuhe und Schutzbrille, getragen werden. Arbeitsplätze sollten gut belüftet sein, um das Risiko einer Inhalation zu minimieren. Bei Verschlucken oder versehentlichem Kontakt ist ärztliche Hilfe erforderlich. Auch die möglichen Auswirkungen von Nickeldifluorid auf die Umwelt müssen berücksichtigt werden, und bei der Entsorgung müssen entsprechende Vorschriften eingehalten werden, um eine Kontamination zu vermeiden.
| Gefahrensymbole | Gefahr für die Gesundheit |
| Sicherheitsbeschreibung | Verursacht Haut- und Augenreizungen. Gesundheitsschädlich beim Einatmen oder Verschlucken. Eine längere Exposition kann schwerwiegendere gesundheitliche Auswirkungen haben. Mit geeigneter Schutzausrüstung handhaben. Einatmen und Kontakt vermeiden. |
| UN-Identifikationsnummern | Nicht zugeschrieben |
| HS-Code | 2826.20.1000 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | III |
| Toxizität | Mäßig giftig |
Methoden zur Synthese von Nickelfluorid
Nickeldifluorid kann auf verschiedene Weise synthetisiert werden. Ein gängiger Ansatz beinhaltet die Reaktion zwischen Nickeloxid (NiO) oder Nickelcarbonat (NiCO3) mit Flusssäure (HF):
- Reaktion mit Flusssäure :
- Nickeloxid (NiO)-Methode: NiO + 2 HF → NiF2 + H2O
- Nickelcarbonat (NiCO3) Methode: NiCO3 + 4 HF → NiF2 + CO2 + 2 H2O
Eine andere Methode nutzt die Reaktion zwischen Nickelchlorid (NiCl2) und Ammoniumfluorid (NH4F):
- Reaktion mit Ammoniumfluorid : NiCl2 + 2 NH4F → NiF2 + 2 NH4Cl
Darüber hinaus kann Nickeldifluorid durch die Reaktion von Nickeloxid mit Ammoniumfluorid gewonnen werden:
- Reaktion mit Ammoniumfluorid (Nickeloxid-Methode) : NiO + 2 NH4F → NiF2 + 2 H2O + (NH4)2O
Diese Methoden finden im Allgemeinen bei kontrollierten Temperaturen und Bedingungen statt, um eine ordnungsgemäße Synthese und Produktreinheit sicherzustellen. Aufgrund ihrer potenziellen Gefahren ist es wichtig, mit Flusssäure und anderen Reagenzien vorsichtig umzugehen. Das resultierende Nickeldifluorid kann gereinigt und für verschiedene Anwendungen wie Batteriematerialien und Galvanisierung verarbeitet werden.
Verwendung von Nickelfluorid
Nickeldifluorid (NiF2) findet aufgrund seiner einzigartigen Eigenschaften vielfältige Anwendungen. Es dient in verschiedenen Branchen zu unterschiedlichen Zwecken:
- Batterietechnologie: Wird als Komponente in Lithium-Ionen-Batterien verwendet und verbessert deren Leistung und Stabilität.
- Galvanisieren: Wird in Galvanisierungsprozessen verwendet, um dauerhafte, korrosionsbeständige Nickelbeschichtungen auf verschiedenen Materialien zu erzeugen.
- Katalyse: Wirkt als Katalysator bei bestimmten chemischen Reaktionen und unterstützt die Synthese wertvoller Produkte.
- Glas und Keramik: Wird in die Herstellung von Spezialglas und Keramik einbezogen und verbessert deren Eigenschaften und Merkmale.
- Fluoridierung: Wird zur Fluoridierung von Wasser verwendet, um die Zahngesundheit durch Vorbeugung von Karies zu verbessern.
- Chemische Herstellung: Dient als Vorstufe bei der Synthese anderer Nickelverbindungen und Chemikalien.
- Keramikkondensatoren: kommen bei der Herstellung von Keramikkondensatoren vor, die in der Elektronik und Telekommunikation verwendet werden.
- Pharmazeutika: werden als Reagenzien in bestimmten pharmazeutischen Prozessen und in der Forschung verwendet.
- Fotografie: Historisch gesehen in der Fotoindustrie als Bestandteil bestimmter Fotoentwickler verwendet.
- Metalllegierungszusatz: Wird bestimmten Metalllegierungen zugesetzt, um deren Eigenschaften wie Festigkeit und Zähigkeit zu verbessern.
Die anpassungsfähigen Eigenschaften von Nickeldifluorid machen es zu einer wertvollen Ressource in einer Vielzahl von Branchen und tragen zu Fortschritten in der Technologie, im Gesundheitswesen und in der Fertigung bei.
Fragen:
F: Welche Produkte entstehen an den beiden Elektroden während der Elektrolyse einer NiF2(aq)-Lösung?
A: An der Kathode entsteht metallisches Nickel (Ni), während an der Anode Fluorgas (F2) entsteht.
F: Was produziert die NiF2-Elektrolyse?
A: Bei der Elektrolyse von NiF2 entsteht an der Kathode metallisches Nickel und an der Anode entsteht Fluorgas.
F: Die Verbindung NiF2 ist eine ionische Verbindung. Aus welchen Ionen besteht es?
A: NiF2 besteht aus Nickelionen (Ni²⁺) und F-Ionen.
F: Welche Art von Reaktion ist Ni(s) + F2 -> NiF2(s)?
A: Die Reaktion Ni(s) + F2 → NiF2(s) ist eine Kombinationsreaktion (Synthesereaktion).
F: Wie heißt die Verbindung mit der Formel NiF2?
A: Die Verbindung mit der Formel NiF2 heißt Nickel(II)-difluorid.
F: Wo wird Nickel(II)-Fluorid verwendet?
A: Nickel(II)-difluorid wird in der Batterietechnologie, Galvanisierung, Katalysatoren und Keramikherstellung verwendet.
F: Wie lautet die Formel für Nickel(II)-Fluorid?
A: Die Formel für Nickel(II)-difluorid lautet NiF2.
F: Fällt Nickel(II)-Fluorid und Natriumhydroxid aus?
A: Ja, sie fallen in Form eines grünen Feststoffs aus, Nickel(II)-hydroxid.
F: Leitet Nickelfluorid Strom?
A: Ja, Nickeldifluorid kann im geschmolzenen Zustand oder wenn es in Wasser gelöst ist, Elektrizität leiten.
F: Ist geschmolzenes Nickelfluorid oder Graphit leitfähiger?
A: Geschmolzenes Nickeldifluorid ist aufgrund seiner ionischen Natur und seiner mobilen Ionen leitfähiger als Graphit.
