Nickel(II)-chlorid, bekannt als NiCl2, ist eine grünlich-gelbe chemische Verbindung. Es wird häufig in der Galvanisierung, in Katalysatoren und als Vorstufe bei der Synthese anderer Nickelverbindungen verwendet.
| Name der IUPAC | Nickel(II)-chlorid |
| Molekularformel | NiCl2 |
| CAS-Nummer | 7718-54-9 |
| Synonyme | Nickelchlorid, Nickeldichlorid, Dichlornickel, Nickelchlorid |
| InChI | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
Eigenschaften von Nickelchlorid
Nickelchlorid-Formel
Die Formel für Nickeldichlorid lautet NiCl2. Dies weist darauf hin, dass jedes Nickeldichlorid-Molekül aus einem Nickelatom besteht, das an zwei Chloratome gebunden ist. Diese chemische Formel liefert wichtige Informationen über die Zusammensetzung und das Verhältnis der in der Verbindung vorhandenen Elemente.
Molmasse von Nickelchlorid
Die Molmasse von Nickeldichlorid, berechnet durch Addition der Atommassen seiner Bestandteile, beträgt etwa 129,6 Gramm pro Mol. Dieser Wert ist nützlich zur Bestimmung der Menge an Nickeldichlorid in einer bestimmten Probe und für verschiedene stöchiometrische Berechnungen.
Siedepunkt von Nickelchlorid
Nickeldichlorid hat einen Siedepunkt von etwa 1,007 Grad Celsius (1,845 Grad Fahrenheit). Bei dieser Temperatur durchläuft die Verbindung einen Phasenübergang vom flüssigen in den gasförmigen Zustand. Der Siedepunkt ist eine wichtige physikalische Eigenschaft, die hilft, das Verhalten von Nickeldichlorid beim Erhitzen zu verstehen.
Schmelzpunkt von Nickelchlorid
Der Schmelzpunkt von Nickeldichlorid liegt bei etwa 1.002 Grad Celsius (1.836 Grad Fahrenheit). Dies ist die Temperatur, bei der die feste Form von Nickeldichlorid in den flüssigen Zustand übergeht. Der Schmelzpunkt ist wichtig für Anwendungen, bei denen Nickeldichlorid gehandhabt und verarbeitet wird.
Dichte von Nickelchlorid g/ml
Die Dichte von Nickeldichlorid beträgt etwa 3,55 Gramm pro Milliliter. Die Dichte ist ein Maß für die Masse pro Volumeneinheit eines Stoffes und gibt Aufschluss über die Kompaktheit des Materials. Die Dichte von Nickeldichlorid hilft bei der Bestimmung seines Verhaltens in verschiedenen Anwendungen und in verschiedenen physikalischen Zuständen.
Molekulargewicht von Nickelchlorid
Das Molekulargewicht von Nickeldichlorid beträgt etwa 129,6 Gramm pro Mol. Sie wird durch Addition der Atommassen von Nickel und Chlor in der Verbindung berechnet. Das Molekulargewicht ist wichtig für das Verständnis der Beziehungen zwischen Masse, Mol und Anzahl der Teilchen bei chemischen Reaktionen.
Struktur von Nickelchlorid
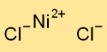
Nickeldichlorid nimmt in seiner festen Form eine Kristallgitterstruktur an. Es besteht aus abwechselnd angeordneten Nickelkationen (Ni2+) und Chloridanionen (Cl-). Diese Anordnung bildet ein dreidimensionales Netzwerk, das zur Stabilität und den physikalischen Eigenschaften von Nickeldichlorid beiträgt.
Löslichkeit von Nickelchlorid
Nickeldichlorid ist in Wasser mäßig löslich. Es kann sich auflösen und eine grünlich-gelbe Lösung bilden. Die Löslichkeit von Nickeldichlorid wird durch Faktoren wie Temperatur und die Anwesenheit anderer Substanzen beeinflusst. Das Verständnis seiner Löslichkeit ist bei verschiedenen industriellen Prozessen und chemischen Anwendungen, bei denen Nickeldichlorid zum Einsatz kommt, wichtig.
| Aussehen | Grünlich-gelber Feststoff |
| Spezifisches Gewicht | 3,55 g/ml |
| Farbe | grünlich-gelb |
| Geruch | Geruchlos |
| Molmasse | 129,6 g/Mol |
| Dichte | 3,55 g/ml |
| Fusionspunkt | 1002 °C (1836 °F) |
| Siedepunkt | 1007 °C (1845 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Mäßig |
| Löslichkeit | Löslich in organischen Lösungsmitteln (Ethanol, Aceton) und Säuren |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Säure (ca. 4) |
Sicherheit und Gefahren von Nickelchlorid
Nickeldichlorid birgt bestimmte Sicherheitsrisiken, die berücksichtigt werden müssen. Es ist wichtig, mit dieser Verbindung vorsichtig umzugehen, um mögliche Risiken zu vermeiden. Nickeldichlorid kann Hautreizungen und Sensibilisierungen verursachen, daher sollten beim Umgang damit Handschuhe und Schutzkleidung getragen werden. Das Einatmen von Nickeldichlorid-Staub oder -Dampf sollte vermieden werden, da dies zu Reizungen der Atemwege führen kann. Die Einnahme von Nickeldichlorid kann schädlich sein und sollte vermieden werden. Darüber hinaus ist Nickeldichlorid giftig für Wasserlebewesen und kann bei Freisetzung in Gewässer Umweltschäden verursachen. Um die mit Nickeldichlorid verbundenen Risiken zu minimieren, sollten ordnungsgemäße Lagerungs-, Handhabungs- und Entsorgungsverfahren befolgt werden.
| Gefahrensymbole | Ätzend, schädlich, umweltgefährdend |
| Sicherheitsbeschreibung | – Handschuhe und Schutzkleidung tragen – Einatmen von Staub oder Dämpfen vermeiden – Verschlucken verhindern – Ordnungsgemäß lagern, handhaben und entsorgen |
| Identifikatoren der Vereinten Nationen | UN3288 |
| HS-Code | 2827.39.80 |
| Gefahrenklasse | 8 (ätzend) |
| Verpackungsgruppe | III |
| Toxizität | Gesundheitsschädlich beim Verschlucken, verursacht Haut- und Augenreizungen |
Methoden zur Nickelchlorid-Synthese
Es gibt verschiedene Methoden zur Synthese von Nickeldichlorid, jede mit ihren eigenen Vorteilen und Anwendungen.
Eine gängige Methode ist die Reaktion von metallischem Nickel oder Nickeloxid mit Salzsäure. Dabei wird metallisches Nickel oder Nickeloxid in einen geeigneten Behälter gegeben und unter langsamer Zugabe von Salzsäure gerührt. Bei der Reaktion zwischen Nickel und Säure entsteht Nickeldichlorid sowie die Freisetzung von Wasserstoffgas.
Eine weitere Synthesemethode beinhaltet die Reaktion zwischen Nickelcarbonat und Salzsäure. Salzsäure löst Nickelcarbonat auf und die erhitzte Lösung reagiert unter Bildung von Nickeldichlorid und setzt Kohlendioxidgas frei.
Salzsäure reagiert mit gelöstem Nickelhydroxid, wenn die Lösung erhitzt oder stehen gelassen wird, was zur Synthese von Nickeldichlorid führt. Die Reaktion führt zur Bildung von Nickeldichlorid und Wasser.
Darüber hinaus kann Nickeldichlorid durch Reaktion von metallischem Nickel mit Chlorgas hergestellt werden. Durch diese direkte Reaktion zwischen den beiden Elementen entsteht Nickeldichlorid.
Diese Synthesemethoden bieten unterschiedliche Wege zur Gewinnung von Nickeldichlorid und ermöglichen Flexibilität hinsichtlich der Rohstoffe und Reaktionsbedingungen. Die Wahl der Methode hängt von Faktoren wie der gewünschten Reinheit des Endprodukts, der Verfügbarkeit von Rohstoffen und spezifischen Anwendungsanforderungen ab.
Verwendung von Nickelchlorid
Aufgrund seiner einzigartigen Eigenschaften findet Nickeldichlorid in verschiedenen Branchen vielfältige Anwendung. Hier sind einige seiner bemerkenswerten Verwendungsmöglichkeiten:
- Galvanisieren: Bei Galvanikverfahren wird typischerweise Nickeldichlorid verwendet, um eine schützende und dekorative Beschichtung auf verschiedenen Oberflächen bereitzustellen. Nickeldichlorid verbessert das Aussehen von Metallen wie Stahl, Messing und Kupfer und sorgt gleichzeitig für Korrosionsbeständigkeit.
- Katalysator: Nickeldichlorid fungiert als Katalysator bei vielen chemischen Reaktionen, einschließlich Hydrierungs- und Polymerisationsprozessen. Es erleichtert die Umwandlung von Reaktanten in gewünschte Produkte und findet Anwendung bei der Herstellung von Arzneimitteln, Kunststoffen und synthetischen Fasern.
- Chemische Synthese: Nickeldichlorid dient als Vorstufe bei der Synthese verschiedener Nickelverbindungen wie Nickeloxid, Nickelsulfid und Nickelcyanid. Die Industrie verwendet diese Verbindungen in Katalysatoren, Pigmenten, Keramik und magnetischen Materialien.
- Batterien: Wiederaufladbare Batterien, insbesondere Nickel-Metallhydrid-Batterien (NiMH), verwenden Nickeldichlorid als Elektrolyt. Es ermöglicht die Zirkulation von Ionen zwischen den Elektroden während der Lade- und Entladezyklen.
- Gasreinigung: Die Industrie verwendet Nickeldichlorid in Gasreinigungsprozessen, um Verunreinigungen wie Schwefelwasserstoff und Kohlenmonoxid zu entfernen. Es findet Anwendung in der Erdgasraffinierung und der petrochemischen Verarbeitung.
- Tierfutterzusatz: Viehfutter, insbesondere Geflügel- und Schweinefutter, enthält Nickeldichlorid als Nahrungsergänzungsmittel. Es fördert die Enzymaktivität und trägt zur allgemeinen Gesundheit und zum Wachstum der Tiere bei.
- Laborforschung: Forscher verwenden Nickeldichlorid in einer Vielzahl von Laborexperimenten, unter anderem in nickelkatalysierten Reaktionen und als Quelle von Nickelionen für chemische Analysen.
Diese vielfältigen Anwendungen zeigen die Vielseitigkeit und Bedeutung von Nickeldichlorid in Sektoren von der Fertigung und Energie bis hin zur Landwirtschaft und Forschung.
Fragen:
F: Welche Ionen sind in einer wässrigen Lösung von NiCl2 vorhanden?
A: In einer wässrigen Lösung von NiCl2 sind die vorhandenen Ionen Ni2+ (Nickelkation) und Cl- (Chloridanion).
F: Ist NiCl2 wasserlöslich?
A: Ja, NiCl2 ist wasserlöslich und bildet eine grünlich-gelbe wässrige Lösung.
F: Welches Metall reagiert spontan mit NiCl2(aq)?
A: Metalle wie Magnesium (Mg) und Zink (Zn) reagieren spontan mit NiCl2(aq), verdrängen Nickel und bilden ihre jeweiligen Chloride.
F: Ist NiCl2 polar oder unpolar?
A: NiCl2 ist aufgrund des Elektronegativitätsunterschieds zwischen Nickel und Chlor eine polare Verbindung, was zu einer ungleichen Ladungsverteilung führt.
F: Ist NiCl2 wässrig?
A: Ja, NiCl2 kann in wässrigem Zustand vorliegen, wenn es in Wasser gelöst wird und eine wässrige Lösung bildet.
F: Wie heißt die Verbindung mit der Formel NiCl2?
A: Die Verbindung mit der Formel NiCl2 heißt Nickel(II)-chlorid.
F: Wie würden Sie 1,00 l einer 0,50 M NiCl2-Lösung herstellen?
A: Um eine 0,50 M NiCl2-Lösung herzustellen, lösen Sie 129,6 Gramm NiCl2 in Wasser und füllen Sie das Volumen auf 1,00 L auf.
F: Was ist das unlösliche Salz, das zwischen einer Lösung von Na2S und NiCl2 entsteht?
A: Wenn eine Lösung von Na2S mit NiCl2 gemischt wird, entsteht unlösliches Nickelsulfid (NiS).
F: Ist NiCl2(aq) ein Feststoff?
A: Nein, NiCl2(aq) bezieht sich auf eine wässrige Lösung von NiCl2, was darauf hinweist, dass es in flüssiger Form vorliegt.
F: Was macht kristallines Nickel(II)-chlorid grün?
A: Die grüne Farbe von kristallinem Nickel(II)-chlorid wird auf das Vorhandensein von Nickel(Ni2+)-Kationen im Kristallgitter zurückgeführt.
F: Ist Nickeldichlorid giftig?
A: Ja, Nickeldichlorid ist giftig und sollte mit Vorsicht gehandhabt werden. Es kann zu Hautreizungen und Atemwegserkrankungen führen und ist beim Verschlucken gesundheitsschädlich.
F: Tritt eine Reaktion auf, wenn wässrige Lösungen von NiCl2 und Na2S kombiniert werden?
A: Ja, wenn wässrige Lösungen von NiCl2 und Na2S kombiniert werden, kommt es zu einer Reaktion, die zur Bildung von unlöslichem Nickelsulfid (NiS) und löslichem Natriumchlorid (NaCl) führt.
F: Wie viele Gramm NiCl2 werden benötigt, um 75,0 ml 0,555 M Lithiumhydroxid zu neutralisieren?
A: Ungefähr 18,4 Gramm NiCl2 sind erforderlich, um 75,0 ml 0,555 M Lithiumhydroxid in einer stöchiometrischen Reaktion zu neutralisieren.
F: Was passiert, wenn man Ammoniumcarbonat, Nickeldichlorid und Wasser mischt?
A: Wenn Ammoniumcarbonat, Nickeldichlorid und Wasser gemischt werden, kommt es zu einer Reaktion, die zur Bildung von Ammoniumchlorid, Nickelcarbonat und Wasser führt.
