Nickelacetat mit der Formel Ni(CH3COO)2 ist eine chemische Verbindung. Aufgrund seiner Nickel- und Acetatbestandteile wird es in verschiedenen Branchen eingesetzt, darunter in der Galvanik und in der Katalysatorsynthese.
| IUPAC-Name | Nickelacetat |
| Molekularformel | Ni(CH3COO)2 |
| CAS-Nummer | 373-02-4 |
| Synonyme | Nickelsalz der Essigsäure, Nickeldiacetat, Nickelacetat |
| InChI | InChI=1S/2C2H4O2.Ni/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschaften von Nickelacetat
Nickelacetat-Formel
Die chemische Formel für Nickeldiacetat lautet Ni(CH3COO)2. Das bedeutet, dass jedes Nickeldiacetat-Molekül ein Ni-Atom enthält, das an zwei CH3COO-Ionen gebunden ist.
Molmasse von Nickelacetat
Die Molmasse von Nickeldiacetat beträgt etwa 176,7 g/mol. Dieser Wert wird durch Addition der Atommassen eines Nickelatoms und vier Sauerstoffatomen aus Acetationen berechnet.
Siedepunkt von Nickelacetat
Nickeldiacetat hat einen Siedepunkt von etwa 140 °C (284 °F). Bei dieser Temperatur geht die Verbindung vom flüssigen in den gasförmigen Zustand über.
Schmelzpunkt von Nickelacetat
Der Schmelzpunkt von Nickeldiacetat liegt bei etwa 140 °C (284 °F). Dies ist die Temperatur, bei der die feste Verbindung flüssig wird.
Dichte von Nickelacetat g/ml
Nickeldiacetat hat eine Dichte von etwa 1,744 g/ml. Dieser Dichtewert stellt die Masse der Verbindung pro Volumeneinheit dar und wird üblicherweise zur Charakterisierung von Flüssigkeiten verwendet.
Molekulargewicht von Nickelacetat
Das Molekulargewicht von Nickeldiacetat, auch Molekulargewicht genannt, beträgt 176,7 g/mol. Dieser Wert wird durch Addition der Atomgewichte aller Atome in der Verbindung berechnet.
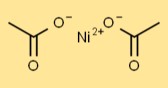
Struktur aus Nickelacetat
Die Struktur von Nickeldiacetat besteht aus einem zentralen Ni-Atom, das an zwei CH3COO-Ionen gebunden ist. Acetat-Ionen tragen zur Koordination um das Nickelatom bei und verleihen ihm eine spezifische Geometrie.
Löslichkeit von Nickelacetat
Nickeldiacetat ist in Wasser mäßig löslich. Es kann sich in Wasser auflösen und eine Lösung bilden. Die Löslichkeit kann je nach Temperatur und Vorhandensein anderer Substanzen in der Lösung variieren.
| Aussehen | Grünes kristallines Pulver |
| Spezifisches Gewicht | ~1.744 g/ml |
| Farbe | Grün |
| Geruch | Geruchlos |
| Molmasse | ~176,7 g/Mol |
| Dichte | ~1.744 g/ml |
| Fusionspunkt | ~140°C (284°F) |
| Siedepunkt | ~140°C (284°F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Mäßig |
| Löslichkeit | Löslich in verschiedenen Lösungsmitteln |
| Dampfdruck | Nicht gut dokumentiert |
| Wasserdampfdichte | Nicht gut dokumentiert |
| pKa | Nicht gut dokumentiert |
| pH-Wert | Nicht gut dokumentiert |
Sicherheit und Gefahren von Nickelacetat
Nickeldiacetat birgt potenzielle Sicherheitsrisiken. Bei Kontakt oder Einatmen kann es zu Reizungen der Haut, Augen und Atemwege kommen. Vermeiden Sie die Einnahme, da dies schädliche Auswirkungen haben kann. Um das Einatmen der Dämpfe zu vermeiden, ist eine ausreichende Belüftung erforderlich. Tragen Sie bei der Handhabung geeignete Schutzausrüstung wie Handschuhe und Schutzbrille. Entsorgen Sie es ordnungsgemäß und vermeiden Sie, dass es in die Umwelt gelangt. Bei Exposition einen Arzt aufsuchen. Befolgen Sie bei der Verwendung von Nickeldiacetat die Sicherheitsdatenblätter und Anweisungen, um die mit der Handhabung, Lagerung und Entsorgung verbundenen Risiken zu minimieren.
| Gefahrensymbole | Gefahr für die Gesundheit |
| Sicherheitsbeschreibung | Verursacht Haut- und Augenreizungen. Gesundheitsschädlich beim Verschlucken oder Einatmen. Freisetzung in die Umwelt vermeiden. Schutzausrüstung tragen. Bei Exposition einen Arzt aufsuchen. |
| UN-Identifikationsnummern | UN3077 (Klasse 9) |
| HS-Code | 2915.12.00 |
| Gefahrenklasse | 9 (Verschiedene gefährliche Güter) |
| Verpackungsgruppe | III |
| Toxizität | Mäßige Toxizität; kann bei Verschlucken, Einatmen oder Kontakt mit Haut oder Augen Reizungen und Schäden verursachen. |
Methoden zur Synthese von Nickelacetat
Nickeldiacetat kann auf verschiedene Weise synthetisiert werden. Ein gängiger Ansatz ist die Reaktion von Nickeloxid (NiO) oder Nickelcarbonat (NiCO3) mit Essigsäure (CH3COOH) oder deren Derivaten. Diese Reaktion läuft unter kontrollierten Bedingungen ab und führt zur Bildung von Nickeldiacetat und Wasser als Nebenprodukte. Eine andere Methode besteht darin, metallisches Nickel oder Nickelhydroxid (Ni(OH)2) mit Essigsäure oder ihren Salzen zu behandeln, wodurch die Bildung von Nickeldiacetat erleichtert wird.
Darüber hinaus kann ein Fällungsprozess eingesetzt werden, bei dem ein lösliches Nickelsalz wie Nickelchlorid (NiCl2) mit einem löslichen Acetatsalz gemischt wird. Durch diese Mischung fällt das Nickeldiacetat aus der Lösung aus, das dann abgetrennt und gesammelt werden kann. Eine sorgfältige pH-Wert-Einstellung während dieses Prozesses trägt dazu bei, optimale Ergebnisse zu erzielen.
Diese Synthesemethoden sind für die Herstellung von Nickeldiacetat für verschiedene Anwendungen, einschließlich seiner Verwendung als Katalysator und Vorläufer in chemischen Reaktionen, von wesentlicher Bedeutung. Die Wahl der Methode hängt von Faktoren wie gewünschter Reinheit, Effizienz und Produktionsumfang ab.
Verwendung von Nickelacetat
Aufgrund seiner besonderen Eigenschaften und chemischen Zusammensetzung findet Nickeldiacetat vielseitige Anwendungen in verschiedenen Branchen. Einige wichtige Verwendungszwecke sind:
- Galvanisieren: Nickeldiacetat dient als Quelle für Nickelionen in Galvanisierungsprozessen. Es erleichtert die Abscheidung einer dünnen Nickelschicht auf verschiedenen Substraten, verbessert die Korrosionsbeständigkeit und sorgt für ein dekoratives Finish.
- Katalysatorsynthese: Chemiker verwenden es als Vorläufer, um Katalysatoren für mehrere chemische Reaktionen herzustellen. Branchen wie die Petrochemie und die Pharmaindustrie sind stark auf nickelhaltige Katalysatoren angewiesen.
- Textilindustrie: Bei Textilfärbeprozessen hilft es, Farbstoffe auf Stofffasern zu fixieren, die Farbstoffhaftung und Farbechtheit zu verbessern.
- Laborreagenz: Wissenschaftler verwenden Nickeldiacetat als Reagenz zum Nachweis und zur Identifizierung bestimmter Verbindungen und können so auf bestimmte funktionelle Gruppen testen.
- Oberflächenbehandlung: Hersteller wenden es bei Oberflächenbehandlungsanwendungen an, beispielsweise bei der Herstellung von Leiterplatten. Es hilft, eine Schutzschicht auf Kupferoberflächen zu bilden.
- Organische Synthese: Bei verschiedenen organischen Synthesereaktionen spielt Nickeldiacetat eine entscheidende Rolle bei der Bildung von Kohlenstoff-Kohlenstoff- und Kohlenstoff-Heteroatom-Bindungen.
- Gasreinigung: Sie spielt eine Schlüsselrolle bei Gasreinigungsprozessen, insbesondere bei der Entfernung von Verunreinigungen wie Schwefelwasserstoff aus Industriegasen.
- Analytische Chemie: Nickeldiacetat ist ein Standardreagenz in der analytischen Chemie, das für Kalibrierungs- und Qualitätskontrollzwecke verwendet wird.
Insgesamt unterstreichen die vielfältigen Anwendungen von Nickeldiacetat seine branchenübergreifende Bedeutung, von der Verbesserung der Produktästhetik bis hin zur Unterstützung kritischer chemischer Transformationen und Prozesse.
Fragen:
F: Können Acetal und Nickel in einem Kreislauf gemischt werden?
A: Das Mischen von Acetal und Nickel in einer Schnalle wird im Allgemeinen nicht empfohlen, da Acetal mit bestimmten Metallen reagieren und möglicherweise Korrosion und Schäden an Schnallenkomponenten verursachen kann.
F: Wie lautet die richtige Formel für die ionische Verbindung Nickelacetat?
A: Die korrekte Formel für Nickeldiacetat, eine ionische Verbindung, lautet Ni(CH3COO)2.
F: Gibt es für Nickel(ii)acetat + Eisen(ii)bromid eine empirische Formel?
A: Nickel(II)-diacetat und Eisen(II)-bromid bilden keine direkte Verbindung, daher ist eine empirische Formel nicht anwendbar.
F: Was ist ein Acetal-Nickel-Wasserblock?
A: Ein Acetal-Nickel-Wasserblock bezieht sich auf eine Kühlkomponente, die in PC-Flüssigkeitskühlsystemen verwendet wird und typischerweise aus Acetal-Kunststoff besteht und eine vernickelte Oberfläche aufweist.
F: Wie hoch sind die Reaktionsgeschwindigkeiten von Nickel und Kupfer mit Essigsäure?
A: Nickel und Kupfer reagieren langsam mit Essigsäure, setzen dabei Wasserstoffgas frei und bilden ihre jeweiligen Diacetatsalze.
F: Wie kann Nickelacetat hergestellt werden?
A: Nickeldiacetat kann durch Reaktion von Nickeloxid oder Nickelcarbonat mit Essigsäure und anschließender Kristallisation und Reinigung hergestellt werden.
F: Wie entferne ich Nickelacetat?
A: Entsorgen Sie Nickeldiacetat als gefährlichen Abfall gemäß den örtlichen Vorschriften. Es ist wichtig, die Abfallentsorgungsbehörden bezüglich geeigneter Entsorgungsmethoden zu konsultieren.
F: Wie lautet die Formel für Nickel(ii)-acetat?
A: Die Formel für Nickel(II)-diacetat lautet Ni(CH3COO)2.
F: Ist Nickelacetat löslich?
A: Ja, Nickeldiacetat ist in Wasser mäßig löslich und bildet eine Lösung, die in einer Vielzahl von Anwendungen verwendet werden kann.
