Natriumzinkat ist eine chemische Verbindung mit der Formel Na2Zn(OH)4. Es handelt sich um ein weißes festes Pulver, das als Vorstufe bei der Synthese von Zinkoxid-Nanopartikeln und als Reagenz in der organischen Chemie verwendet wird.
| IUPAC-Name | Natriumzinkat |
| Molekularformel | Na2Zn(OH)4 |
| CAS-Nummer | 12179-14-5 |
| Synonyme | Natriumzinkhydroxid, Natriumzinkat, Dinatriumtetrahydroxyzinkat, Zink, Tetrahydroxid |
| InChI | InChI=1S/2Na.O2Zn/c;;1-3-5-6-4-2/q2*+1;-2; |
Natriumzinkat-Formel
Die chemische Formel für Natriumzinkat lautet Na2Zn(OH)4, was darauf hinweist, dass es zwei Natriumionen (Na+) und ein Zinkoxidion (ZnO2-) enthält. Die Formel wird verwendet, um die Zusammensetzung der Verbindung darzustellen und kann zur Berechnung der Molmasse, des Molekulargewichts und anderer Eigenschaften der Verbindung verwendet werden. Die Formel kann auch verwendet werden, um chemische Gleichungen zu schreiben und die Produkte von Reaktionen vorherzusagen, an denen Natriumzinkat beteiligt ist.
Molmasse von Natriumzinkat:
Die Molmasse von Natriumzinkat wird durch Addition der Atommassen aller in einem Mol der Verbindung vorhandenen Elemente berechnet. Für Natriumzinkat (Na2Zn(OH)4) beträgt die Molmasse etwa 179,42 g/mol. Dieser Wert kann nützlich sein, um die Menge an Natriumzinkat zu bestimmen, die zur Herstellung einer bestimmten Lösungsmenge benötigt wird, oder um die Masse der Verbindung in einer bestimmten Probe zu bestimmen.
Siedepunkt von Natriumzinkat:
Na2Zn(OH)4 ist eine feste Verbindung und hat keinen Siedepunkt. Allerdings zersetzt es sich bei hohen Temperaturen und die entstehenden Gase können je nach Zusammensetzung Siedepunkte haben. Daher ist der Siedepunkt von Na2Zn(OH)4 keine relevante Eigenschaft.
Dichte von Natriumzinkat g/ml:
Die Dichte von Na2Zn(OH)4 beträgt etwa 2,7 g/cm³. Dieser Wert kann nützlich sein, um die Masse eines bestimmten Volumens von Na2Zn(OH)4 oder das Volumen einer bestimmten Masse von Natriumzinkat zu bestimmen. Die Dichte hängt von Temperatur und Druck ab und kann je nach den spezifischen Bedingungen des Experiments variieren.
Molekulargewicht von Natriumzinkat:
Das Molekulargewicht von Na2Zn(OH)4 wird durch Addition der Atomgewichte aller Atome im Molekül berechnet. Natriumzinkat hat ein Molekulargewicht von etwa 179,42 g/mol. Das Molekulargewicht ist eine wichtige Eigenschaft, da es zur Berechnung der Menge an Natriumzinkat verwendet wird, die in einer Reaktion oder Formulierung erforderlich ist.
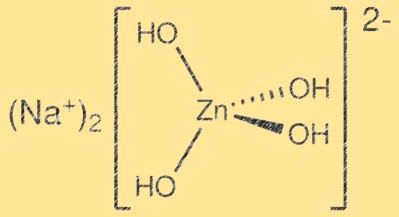
Struktur von Natriumzinkat:
Na2Zn(OH)4 hat eine komplexe Kristallstruktur mit Schichten aus ZnO4-Tetraedern und Na2O6-Oktaedern. ZnO4-Tetraeder teilen sich Ecken, um ein dreidimensionales Gitter zu bilden, während Na2O6-Oktaeder die Zwischenräume besetzen. Die resultierende Struktur ist schichtförmig und kann als Ableitung der Wurtzitstruktur beschrieben werden. Die Schichten werden durch Van-der-Waals-Kräfte zusammengehalten und die resultierende Kristallstruktur ist relativ schwach.
| Aussehen | Weißes festes Pulver |
| Spezifisches Gewicht | 2,7 g/cm³ |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 179,42 g/Mol |
| Dichte | 2,7 g/cm³ |
| Fusionspunkt | N / A |
| Siedepunkt | N / A |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser, unlöslich in organischen Lösungsmitteln |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | N / A |
| pH-Wert | Alkalisch (pH > 7) |
Beachten Sie, dass einige Eigenschaften wie Flammpunkt und Dampfdruck für Natriumzinkat nicht relevant sind, da es sich um eine feste Verbindung handelt.
Sicherheit und Gefahren von Natriumzinkat
Na2Zn(OH)4 birgt bestimmte Sicherheits- und Gefahrenrisiken, die beim Umgang mit der Verbindung berücksichtigt werden müssen. Beim Umgang mit Na2Zn(OH)4 ist es wichtig, geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Die Verbindung kann Haut- und Augenreizungen verursachen und bei Verschlucken kann es zu Magen-Darm-Beschwerden kommen. Na2Zn(OH)4 kann ebenfalls eine Brandgefahr darstellen und sollte an einem kühlen, trockenen Ort, entfernt von Hitze und Zündquellen, gelagert werden. Die ordnungsgemäße Handhabung und Lagerung von Na2Zn(OH)4 kann dazu beitragen, die mit der Verbindung verbundenen Risiken zu minimieren.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | S22: Staub nicht einatmen. S24/25: Kontakt mit Haut und Augen vermeiden. S37/39: Geeignete Handschuhe und Augen-/Gesichtsschutz tragen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2834.29 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Die genaue Toxizität von Natriumzinkat ist nicht genau geklärt, es kann jedoch Haut- und Augenreizungen verursachen und bei Einnahme gesundheitsschädlich sein. Es ist wichtig, vorsichtig mit der Masse umzugehen und geeignete persönliche Schutzausrüstung zu tragen. |
Methoden zur Synthese von Natriumzinkat
Es gibt verschiedene Methoden zur Synthese von Na2Zn(OH)4, die gebräuchlichste Methode besteht jedoch darin, Zinkoxid und Natriumhydroxid in einer wässrigen Lösung zu mischen. Zunächst müssen Sie Zinkoxid mit Natriumhydroxid in einer wässrigen Lösung mischen. Dann erhitzen und rühren Sie die Mischung, bis eine klare Lösung entsteht. Sobald die Lösung abgekühlt ist, fällt Na2Zn(OH)4 aus der Lösung aus, das mit Wasser gewaschen und getrocknet werden muss, um das Endprodukt zu erhalten.
Eine andere Möglichkeit, Na2Zn(OH)4 zu synthetisieren, besteht darin, Zink zu einer Natriumhydroxidlösung zu geben und die Mischung zu erhitzen, bis eine klare Lösung entsteht. Sobald die Lösung abgekühlt ist, fällt Na2Zn(OH)4 aus der Lösung aus, das mit Wasser gewaschen und getrocknet werden muss, um das Endprodukt zu erhalten.
Es ist wichtig, die Synthese von Na2Zn(OH)4 in einem gut belüfteten Bereich durchzuführen und geeignete persönliche Schutzausrüstung zu tragen. Auch beim Umgang mit Natriumhydroxid ist Vorsicht geboten, da es ätzend sein und Haut- und Augenreizungen verursachen kann.
Verwendung von Natriumzinkat
Verschiedene Industrien nutzen Na2Zn(OH)4 für verschiedene Zwecke. Eine seiner Hauptanwendungen ist die Verwendung als Vorstufe für die Synthese von Zinkoxid, das Hersteller bei der Herstellung von Gummi, Keramik und anderen Produkten verwenden. Na2Zn(OH)4 fungiert als Stabilisator bei der Herstellung von Kunstfasern und Kunststoffen.
In der Agrarindustrie verwenden Landwirte Na2Zn(OH)4 als Dünger, um Pflanzen mit essentiellen Nährstoffen wie Zink zu versorgen. Außerdem kann es Pflanzen als Fungizid vor Pilzkrankheiten schützen.
Hersteller von Pigmenten wie Zinkgelb verwenden bei ihrer Produktion Na2Zn(OH)4, das häufig in Farben und Beschichtungen verwendet wird. Darüber hinaus verwenden Industrien Na2Zn(OH)4 als Korrosionsinhibitor, um Metalle vor Korrosion zu schützen.
In der Pharmaindustrie dient Na2Zn(OH)4 als Quelle für Zink, einen essentiellen Nährstoff für die menschliche Gesundheit. Zink ist ein wesentliches Element in verschiedenen biologischen Prozessen und spielt eine wesentliche Rolle bei der Aufrechterhaltung eines gesunden Immunsystems und der Förderung der Wundheilung.
Insgesamt hat Na2Zn(OH)4 eine Reihe wichtiger Anwendungen in verschiedenen Branchen und ist eine vielseitige Verbindung mit vielen Einsatzmöglichkeiten.
Fragen:
Ist Natriumzinkat ein Salz?
Natriumzinkat gilt als Salz, da es durch die Reaktion eines Metalls (Zink) und einer Base (Natriumhydroxid) eine ionische Verbindung bildet. Elektrostatische Kräfte halten die positiv geladenen Zinkionen und die negativ geladenen Natrium- und Hydroxidionen zusammen. Salze sind ionische Verbindungen, die durch die Reaktion zwischen einer Säure und einer Base oder einem Metall und einem Nichtmetall entstehen. Obwohl Na2Zn(OH)4 nicht durch die Reaktion einer Säure und einer Base entsteht, erfüllt es dennoch die allgemeine Definition eines Salzes als ionische Verbindung.
