Natriumthiosulfat ist eine chemische Verbindung mit der Formel Na2S2O3. Es wird üblicherweise als Fixiermittel bei der fotografischen Entwicklung und als Reduktionsmittel bei bestimmten chemischen Reaktionen verwendet.
| IUPAC-Name | Natriumthiosulfat |
| Molekularformel | Na2S2O3 |
| CAS-Nummer | 7772-98-7 |
| Synonyme | Natriumhyposulfit, Natriumthiosulfat, Dinatriumsalz der Thioschwefelsäure, Natriumthiosulfat-Pentahydrat |
| InChI | InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Eigenschaften von Natriumthiosulfat
Natriumthiosulfat-Formel
Die chemische Formel für Natriumthiosulfat lautet Na2S2O3. Es besteht aus zwei Na+-Ionen und zwei S2O3 2–Ionen. Die Formel zeigt die Art und Anzahl der in einem Molekül der Verbindung vorhandenen Atome.
Molmasse von Natriumthiosulfat
Die Molmasse von Na2S2O3 beträgt 158,11 g/mol. Sie wird berechnet, indem die Atommassen aller in einem Mol der Verbindung vorhandenen Atome addiert werden. Dieser Wert ist nützlich, um die Menge an Na2S2O3 zu bestimmen, die für eine bestimmte Reaktion benötigt wird, oder um die Konzentration einer Lösung zu berechnen.
Siedepunkt von Natriumthiosulfat
Na2S2O3 hat keinen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Bei Normaldruck zersetzt es sich zwischen 48 und 55 °C unter Freisetzung von Schwefeldioxid. Diese Eigenschaft macht es für Hochtemperaturanwendungen ungeeignet.
Natriumthiosulfat Schmelzpunkt
Der Schmelzpunkt von Na2S2O3 beträgt 48,3°C. Dies ist die Temperatur, bei der die feste Verbindung in den flüssigen Zustand übergeht. Sein Schmelzpunkt ist im Vergleich zu anderen anorganischen Salzen relativ niedrig, wodurch es sich leicht in Wasser löst.
Dichte von Natriumthiosulfat g/ml
Die Dichte von Na2S2O3 beträgt 1,667 g/ml. Dieser Wert bezieht sich auf die Masse des Stoffes pro Volumeneinheit. Sie ist größer als die Dichte von Wasser, was bedeutet, dass Na2S2O3 im Wasser sinkt.
Molekulargewicht von Natriumthiosulfat
Das Molekulargewicht von Na2S2O3 beträgt 158,11 g/mol. Es ist die Summe der Atomgewichte aller in einem Molekül der Verbindung vorhandenen Atome. Das Molekulargewicht ist nützlich, um die Menge an Na2S2O3 zu bestimmen, die für eine bestimmte Reaktion benötigt wird, oder um die Konzentration einer Lösung zu berechnen.
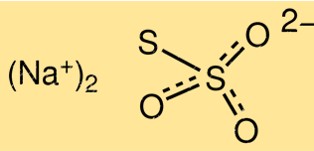
Struktur von Natriumthiosulfat
Die Struktur von Na2S2O3 besteht aus zwei S2O3 2- Ionen, verbunden mit einem Natriumion, Na+. Das Molekül hat die Form einer trigonalen Pyramide mit einem Bindungswinkel von etwa 103 Grad. Das Thiosulfat-Ion hat eine Schwefel-Schwefel-Bindung und zwei Schwefel-Sauerstoff-Bindungen.
Löslichkeit von Natriumthiosulfat
Na2S2O3 ist in Wasser sehr gut löslich. Die Löslichkeit von Na2S2O3 in Wasser steigt mit der Temperatur, wobei sich etwa 70 g der Verbindung in 100 ml Wasser bei 25 °C lösen. Es ist auch in Glycerin löslich und in Alkohol schwer löslich. Aufgrund seiner Löslichkeit ist es für verschiedene Anwendungen nützlich, beispielsweise für die fotografische Entwicklung und medizinische Behandlungen.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 1.667 g/ml |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 158,11 g/Mol |
| Dichte | 1.667 g/ml |
| Fusionspunkt | 48,3°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Glycerin und schwer löslich in Alkohol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Neutral (pH 7) |
Sicherheit und Gefahren von Natriumthiosulfat
Na2S2O3 gilt im Allgemeinen als sicher, wenn es richtig gehandhabt wird. Es kann jedoch schädlich sein, wenn es verschluckt, eingeatmet oder mit Augen oder Haut in Berührung kommt. Die Verbindung kann Haut- und Augenreizungen verursachen und eine längere Exposition kann zu Dermatitis führen. Die Einnahme von Na2S2O3 kann Magen-Darm-Beschwerden wie Übelkeit und Erbrechen verursachen. Bei der Arbeit mit Na2S2O3 ist es wichtig, geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Bei Exposition sollte der betroffene Bereich mit Wasser gespült und gegebenenfalls ein Arzt aufgesucht werden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Kontakt mit Augen, Haut und Kleidung vermeiden. Nicht einnehmen. Tragen Sie geeignete persönliche Schutzausrüstung. |
| UN-Identifikationsnummern | UN3077 |
| HS-Code | 2832.3010.00 |
| Gefahrenklasse | 9 |
| Verpackungsgruppe | III |
| Toxizität | Geringe Toxizität; Die LD50 (oral, Ratte) beträgt 6.200 mg/kg |
Methoden zur Synthese von Natriumthiosulfat
Verschiedene Methoden können Na2S2O3 synthetisieren.
Eine übliche Methode besteht darin, Natriumsulfit mit Schwefel in Gegenwart einer alkalischen Lösung umzusetzen. Eine andere Methode besteht darin, Natriumsulfit mit Schwefeldioxid unter Druck umzusetzen.
Eine Methode zur Herstellung von Na2S2O3 besteht darin, den Schwefel in einer heißen Lösung aus Natriumsulfit und Natriumhydroxid aufzulösen. Die Lösung kühlt ab und jemand filtriert sie, um ein festes Produkt zu erhalten.
Bei dieser Methode wird Schwefeldioxid mit Natriumhydroxid zu Natriumsulfit umgesetzt und anschließend mit elementarem Schwefel zu Na2S2O3 umgesetzt.
Zur Herstellung von Na2S2O3 kann Schwefelsäure mit Natriumsulfit umgesetzt werden, dann die resultierende Lösung erhitzt und Schwefel hinzugefügt werden. Das Natriumsulfit reagiert dann mit dem Schwefel zu Na2S2O3.
Eine andere Methode beinhaltet die Reaktion von Natriumhydroxid mit Schwefel und die anschließende Zugabe von Natriumsulfit zur Bildung von Na2S2O3.
Verwendung von Natriumthiosulfat
Na2S2O3 hat ein breites Einsatzspektrum in verschiedenen Branchen und Anwendungen, darunter:
- Fotografie: Wird als Fixiermittel zum Entfernen unbelichteter Silberhalogenide von Fotoabzügen und Filmen verwendet.
- Wasseraufbereitung: Wird zur Entchlorung von Wasser durch Neutralisierung von Chlor und zur Verhinderung seiner schädlichen Auswirkungen auf Wasserlebewesen verwendet.
- Medizinische Anwendungen: Wird zur Behandlung von Zyanidvergiftungen verwendet, da es mit Zyanid unter Bildung von Thiocyanat reagiert, das weniger giftig ist und aus dem Körper ausgeschieden werden kann.
- Industrielle Anwendungen: Wird als Reduktionsmittel in chemischen Prozessen und als Konservierungsmittel in Textilien, Leder und Papier verwendet.
- Analytische Chemie: Wird als Titriermittel bei der Analyse verschiedener Metalle wie Kupfer und Arsen verwendet.
- Lebensmittel- und Getränkeindustrie: Wird als Lebensmittelkonservierungsmittel zur Verhinderung von Verfärbungen und als Geschmacksverstärker verwendet.
- Gartenbau: Wird verwendet, um die Wirkung von Chlor im Wasser zur Bewässerung von Pflanzen zu neutralisieren.
Fragen:
F: Wofür wird Natriumthiosulfat verwendet?
A: Na2S2O3 hat ein breites Anwendungsspektrum, darunter Fotografie, Wasseraufbereitung, medizinische Behandlungen, industrielle Prozesse, analytische Chemie, Lebensmittel- und Getränkekonservierung sowie Gartenbau.
F: Wie stellt man Natriumthiosulfat her?
A: Na2S2O3 kann durch Reaktion von Natriumsulfit mit Schwefel oder Schwefeldioxid in Gegenwart einer alkalischen Lösung synthetisiert werden. Andere Methoden umfassen die Reaktion von Natriumhydroxid mit Schwefel oder Schwefeldioxid zur Bildung von Natriumsulfit, das dann mit Schwefel zu Na2S2O3 reagiert.
F: Was ist Natriumgoldthiosulfat?
A: Gold Na2S2O3 ist eine komplexe Verbindung, die durch die Reaktion von Goldchlorid und Na2S2O3 entsteht. Es wird in der Vergoldung und in der analytischen Chemie zum Nachweis und zur Quantifizierung von Gold verwendet.
F: Wo kann man Natriumthiosulfat kaufen?
A: Na2S2O3 kann bei Chemielieferanten, Laborbedarfsfirmen und Online-Händlern erworben werden.
F: Wo finde ich Natriumthiosulfat?
A: Na2S2O3 ist in einer Vielzahl von Produkten enthalten, darunter Fotochemikalien, Wasseraufbereitungsprodukte und medizinische Behandlungen.
F: Wie hoch ist die Oxidationszahl von Schwefel in Na2S2O3?
A: Die Oxidationszahl von Schwefel in Na2S2O3 beträgt +2 im Thiosulfat-Ion (S2O3^2-) und +6 im Sulfation (SO4^2-).
F: Wie ermittelt man das Gewicht von Cu aus der Titration von Na2S2O3?
A: Das Gewicht von Cu kann aus dem Volumen und der Molarität der bei der Titration verwendeten Na2S2O3-Lösung berechnet werden, indem die ausgewogene chemische Gleichung für die Reaktion zwischen Cu und Na2S2O3 verwendet wird.
F: Woher wissen Sie, wann eine stöchiometrische Menge Na2S2O3 hinzugefügt wurde?
A: Eine stöchiometrische Menge Na2S2O3 wurde zugegeben, wenn der Endpunkt der Reaktion erreicht ist, was durch eine Änderung der Farbe oder einer anderen physikalischen oder chemischen Eigenschaft angezeigt wird.
F: Wie hoch ist die Endkonzentration an KI, wenn 5 Tropfen 0,15 M KI zu 40 Tropfen Na2S2O3 hinzugefügt werden?
A: Die Endkonzentration von KI kann nicht ohne zusätzliche Informationen bestimmt werden, wie zum Beispiel das Volumen oder die Konzentration der Na2S2O3-Lösung.
F: Wie ermittelt man die Molarität von Na2S2O3?
A: Die Molarität von Na2S2O3 kann aus der Masse der Probe sowie dem Volumen und der Konzentration der zum Auflösen verwendeten Lösung mithilfe der Formel Molarität = Mol gelöster Stoff/Lösungsvolumen in Litern berechnet werden.
