Natriumsulfit, auch bekannt als Na2SO3, ist ein weißes kristallines Pulver, das häufig als Konservierungsmittel in der Lebensmittelindustrie und als Reduktionsmittel in der Fotografie verwendet wird.
| IUPAC-Name | Dinatriumsulfit |
| Molekularformel | Na2SO3 |
| CAS-Nummer | 7757-83-7 |
| Synonyme | Natriumsulfit; Dinatriumsulfit; Schwefelige Säure, Dinatriumsalz; Natriumsulfonat; Natriumsulfit |
| InChI | InChI=1S/2Na.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Eigenschaften von Natriumsulfit
Natriumsulfit-Formel
Die chemische Formel für Natriumsulfit lautet Na2SO3. Es besteht aus zwei Na+-Ionen und einem SO32–Ion. Na+-Ionen tragen eine positive Ladung, während das SO32–Ion eine negative Ladung trägt. Natriumsulfit ist eine ionische Verbindung, die ein weißes kristallines Pulver bildet.
Molmasse von Natriumsulfit
Die Molmasse von Na2SO3 beträgt 126,04 g/mol. Dieser Wert wird durch Addition der Atommassen jedes Elements in der Verbindung erhalten. Die Atommassen von Natrium, Schwefel und Sauerstoff betragen 22,99 g/mol, 32,06 g/mol bzw. 15,99 g/mol. Die Molmasse ist ein wichtiger Parameter für stöchiometrische Berechnungen und kann auch zur Bestimmung der in einer Probe vorhandenen Substanzmenge verwendet werden.
Siedepunkt von Natriumsulfit
Na2SO3 hat einen relativ hohen Siedepunkt von 1650°C. Dies ist auf die starken Ionenbindungen zwischen den Na+- und SO32-Ionen zurückzuführen, deren Aufbrechen eine große Energiemenge erfordert. Der Siedepunkt ist die Temperatur, bei der ein Stoff von der flüssigen Phase in die gasförmige Phase übergeht. Bei dieser Temperatur entspricht der Dampfdruck der Flüssigkeit dem Atmosphärendruck.
Schmelzpunkt von Natriumsulfit
Der Schmelzpunkt von Na2SO3 beträgt 33,4°C. Dieser relativ niedrige Schmelzpunkt ist auf schwache intermolekulare Kräfte zwischen Na2SO3-Molekülen zurückzuführen. Beim Erhitzen werden die intermolekularen Kräfte überwunden und das feste Na2SO3 schmilzt zu einer Flüssigkeit.
Dichte von Natriumsulfit g/ml
Die Dichte von Na2SO3 beträgt 2,633 g/ml. Die Dichte ist definiert als die Masse eines Stoffes pro Volumeneinheit. Die hohe Dichte von Na2SO3 ist auf seine ionische Natur und das Vorhandensein von zwei Natriumionen pro Sulfition in seiner Struktur zurückzuführen.
Molekulargewicht von Natriumsulfit
Das Molekulargewicht von Na2SO3 beträgt 126,04 g/mol. Dieser Wert wird durch Addition der Atomgewichte jedes Elements in der Verbindung erhalten. Das Molekulargewicht ist ein wichtiger Parameter für stöchiometrische Berechnungen und kann auch zur Bestimmung der in einer Probe vorhandenen Substanzmenge verwendet werden.
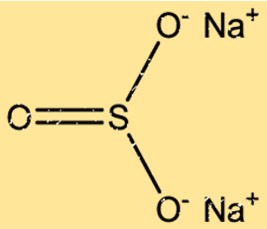
Struktur von Natriumsulfit
Na2SO3 hat eine Kristallstruktur mit zwei Na+-Ionen und einem SO32–Ion, die in einem sich wiederholenden Muster angeordnet sind. Die Na+-Ionen sind in einem flächenzentrierten kubischen Gitter angeordnet, während die SO32–Ionen die oktaedrischen Plätze des Gitters besetzen. Die ionischen Bindungen zwischen den Na+- und SO32–Ionen führen zu einer stabilen Kristallstruktur.
Löslichkeit von Natriumsulfit
Na2SO3 ist in Wasser gut löslich, mit einer Löslichkeit von 22,4 g/100 ml bei 20 °C. Diese hohe Löslichkeit ist auf die ionische Natur von Na2SO3 zurückzuführen, die es ihm ermöglicht, in Wasser zu dissoziieren und Na+- und SO32–Ionen zu bilden. Die Löslichkeit von Na2SO3 in Wasser steigt mit der Temperatur, da die kinetische Energie der Moleküle zunimmt und mehr Ionen in die Lösung abgegeben werden.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 2,633 g/cm³ |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 126,04 g/Mol |
| Dichte | 2.633 g/ml |
| Fusionspunkt | 33,4°C |
| Siedepunkt | 1650°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Glycerin, schwer löslich in Ethanol |
| Dampfdruck | 0 mmHg bei 20°C |
| Wasserdampfdichte | Unzutreffend |
| pKa | 6:35 Uhr |
| pH-Wert | 8,3 – 9,5 (5%ige Lösung) |
Sicherheit und Gefahren von Natriumsulfit
Na2SO3 kann bei unsachgemäßer Handhabung gefährlich sein. Es kann Haut- und Augenreizungen verursachen und bei Verschlucken Übelkeit, Erbrechen und Bauchschmerzen verursachen. Beim Einatmen kann es außerdem zu Reizungen der Atemwege kommen. Darüber hinaus kann Na2SO3 mit anderen Chemikalien reagieren und giftige Gase wie Schwefeldioxid erzeugen, die gesundheitsschädlich sein können. Daher ist es wichtig, beim Umgang mit Na2SO3 geeignete persönliche Schutzausrüstung zu tragen und eine Exposition gegenüber Augen, Haut und Schleimhäuten zu vermeiden. Na2SO3 sollte außerdem an einem kühlen, trockenen und gut belüfteten Ort, entfernt von inkompatiblen Materialien, gelagert werden.
| Gefahrensymbole | Xi,O |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Bei Kontakt sofort mit viel Wasser abspülen und einen Arzt aufsuchen. Nicht einnehmen. Einatmen von Staub vermeiden. Tragen Sie geeignete persönliche Schutzausrüstung. Von Hitze, Funken und Flammen fernhalten. |
| EINE ID | 1384 |
| HS-Code | 283210 |
| Gefahrenklasse | 8 – Ätzende Stoffe |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte) – 1.640 mg/kg; LC50 (Inhalation, Ratte) – 63 mg/m³ |
Methoden zur Synthese von Natriumsulfit
Verschiedene Methoden können Na2SO3 synthetisieren.
Eine übliche Methode ist die Reaktion von Natriumhydroxid mit Schwefeldioxidgas in Gegenwart von Wasser. Bei der Reaktion entstehen als Nebenprodukte Na2SO3 und Wasser.
Bei einer anderen Methode reagiert Natriumcarbonat mit Schwefeldioxidgas in Gegenwart von Wasser und erzeugt dabei Na2SO3 und Kohlendioxidgas. Um die Ausbeute an Na2SO3 zu erhöhen, kann diese Reaktion bei hohen Temperaturen und Drücken durchgeführt werden.
Durch die Reaktion von Natriumbisulfit mit Natriumhydroxid kann Na2SO3 synthetisiert werden. Bei dieser Reaktion entstehen als Nebenprodukte Na2SO3, Wasser und Natriumchlorid.
Eine andere Methode besteht darin, Natriumsulfid mit Schwefeldioxidgas in Gegenwart von Wasser zu reagieren, um Na2SO3 und Schwefelwasserstoffgas zu erzeugen.
Um Na2SO3 zu synthetisieren, muss Natriumsulfat in Gegenwart eines Reduktionsmittels wie Aktivkohle mit Schwefeldioxidgas behandelt werden. Bei dieser Reaktion entstehen Na2SO3 und Kohlendioxid.
Jede dieser Methoden hat ihre eigenen Vor- und Nachteile, und die Wahl der Methode hängt von verschiedenen Faktoren ab, wie der gewünschten Ausbeute, der Reinheit und den Kosten des Produkts sowie der Verfügbarkeit von Reagenzien und Geräten.
Verwendungsmöglichkeiten von Natriumsulfit
Na2SO3 hat mehrere wichtige industrielle und kommerzielle Verwendungszwecke, darunter:
- Fotografie: Wird als Reduktionsmittel und Konservierungsmittel in fotografischen Entwicklungslösungen verwendet. Dies hilft, das Bild zu stabilisieren und ein Ausbleichen zu verhindern.
- Wasseraufbereitung: Wird zur Entfernung von Chlor und überschüssigem Sauerstoff aus dem Wasser in industriellen und kommunalen Wasseraufbereitungsanlagen verwendet. Es hilft auch, Korrosion von Rohren und Geräten zu verhindern.
- Papier- und Zellstoffindustrie: Wird bei der Herstellung von Papier und Zellstoff verwendet, um den Zellstoff aufzuhellen und den Ligningehalt zu reduzieren. Dies trägt dazu bei, die Qualität und Farbe des Papiers zu verbessern.
- Lebensmittelindustrie: Wird in der Lebensmittelindustrie als Konservierungsmittel und Antioxidans verwendet. Es hilft, Verfärbungen und den Verderb von Lebensmitteln wie Trockenfrüchten, Wein und Bier zu verhindern.
- Textilindustrie: Wird in der Textilindustrie als Reduktionsmittel und Bleichmittel verwendet, um überschüssige Farbstoffe zu entfernen und die Farbechtheit von Stoffen zu verbessern.
- Chemische Industrie: Wird als Reduktionsmittel bei verschiedenen chemischen Reaktionen verwendet, beispielsweise bei der Herstellung von Farbstoffen, Arzneimitteln und Polymeren.
- Weitere Verwendungszwecke: Wird auch bei der Herstellung von Waschmitteln, Lederprodukten und Körperpflegeprodukten wie Haarfärbemitteln und Shampoos verwendet.
Fragen:
F: Was ist normales Natriumsulfit in einem Kessel?
A: Die normale Na2SO3-Konzentration in einem Kessel liegt im Allgemeinen zwischen 20 und 40 Teilen pro Million (ppm), abhängig vom Betriebsdruck und anderen Faktoren.
F: Wie gleicht man Schwefeldioxid mit Natriumhydroxid aus, um Natriumsulfit und Wasser zu bilden?
A: Um die Gleichung für die Reaktion von Schwefeldioxid und Natriumhydroxid unter Bildung von Na2SO3 und Wasser auszugleichen, müssen Sie sicherstellen, dass auf beiden Seiten der Gleichung die gleiche Anzahl von Atomen jedes Elements vorhanden ist. Die ausgeglichene Gleichung wäre SO2 + 2NaOH → Na2SO3 + H2O.
F: Was ist Natriumsulfit?
A: Na2SO3 ist eine weiße kristalline Verbindung, die häufig in verschiedenen industriellen und kommerziellen Anwendungen verwendet wird, beispielsweise in der Fotografie, Wasseraufbereitung, Papierherstellung und Lebensmittelkonservierung.
F: Wie lautet die Formel für Natriumsulfit?
A: Die Formel für Natriumsulfit lautet Na2SO3.
F: Basiert Natriumsulfit?
A: Na2SO3 ist ein Salz einer starken Base (Natriumhydroxid) und einer schwachen Säure (schweflige Säure) und hat daher basische Eigenschaften. Im Allgemeinen gilt es jedoch nicht als solide Grundlage.
F: Ist Natriumsulfit in Wasser stabil?
A: Na2SO3 ist in Wasser relativ stabil, kann sich jedoch im Laufe der Zeit allmählich zersetzen, insbesondere in Gegenwart von Sauerstoff oder anderen Oxidationsmitteln.
F: Ist Natriumsulfit brennbar?
A: Na2SO3 ist nicht brennbar, kann aber mit bestimmten Oxidationsmitteln reagieren und Schwefeldioxid freisetzen, das die Atemwege reizt und entzündlich sein kann.
F: Wo kann man Natriumsulfit vor Ort kaufen?
A: Na2SO3 kann bei Chemielieferanten, Industrielieferanten und einigen Fachhändlern erworben werden. Möglicherweise ist es auch in einigen örtlichen Baumärkten oder Baumärkten erhältlich.
F: Welche Lebensmittel enthalten Natriumsulfit?
A: Na2SO3 wird häufig als Konservierungsmittel in Lebensmitteln wie Wein, Bier, Trockenfrüchten und einigen verarbeiteten Fleischsorten verwendet.
F: Welches Produkt entspricht Natriumsulfit?
A: Natriumbisulfit ist eine ähnliche Verbindung, die in einigen Anwendungen als Ersatz für Na2SO3 verwendet werden kann. Andere Ersatzstoffe können Natriummetabisulfit oder Kaliummetabisulfit sein.
