Natriumsulfid (Sulfid) ist eine chemische Verbindung mit der Formel Na2S. Es wird häufig in der Papier- und Zellstoffindustrie sowie in der Wasseraufbereitung zur Entfernung von Schwermetallen eingesetzt.
| IUPAC-Name | Dinatriumsulfid |
| Molekularformel | Na2S |
| CAS-Nummer | 1313-82-2 |
| Synonyme | Natriumsulfid, Natriummonosulfid, Dinatriumsulfid, wasserfreies Natriumsulfid, nichtahydratisiertes Natriumsulfid, Natriumsulfid |
| InChI | InChI=1S/2Na.S/q2*+1;-2 |
Molmasse von Natriumsulfid
Natriumsulfid hat eine Molmasse von 78,045 g/mol. Das bedeutet, dass ein Mol Natriumsulfid 78,045 Gramm der Verbindung enthält. Die Molmasse ist eine Größe, die zur Berechnung der Menge einer Substanz, die für eine Reaktion benötigt wird, sowie zur Bestimmung des Molekulargewichts einer Verbindung nützlich ist.
Siedepunkt von Natriumsulfid
Natriumsulfid hat einen relativ hohen Siedepunkt von >1180 °C (2156 °F). Das bedeutet, dass eine erhebliche Energiemenge erforderlich ist, um die feste Form von Natriumsulfid in seine Gasform umzuwandeln. Der hohe Siedepunkt weist auch darauf hin, dass Natriumsulfid bei hohen Temperaturen eine stabile Verbindung ist.
Schmelzpunkt von Natriumsulfid
Natriumsulfid hat einen Schmelzpunkt von 1.180 °C (2.156 °F). Das bedeutet, dass eine erhebliche Energiemenge erforderlich ist, um die feste Form von Natriumsulfid in seine flüssige Form umzuwandeln. Der hohe Schmelzpunkt von Natriumsulfid weist auch darauf hin, dass es sich bei hohen Temperaturen um eine stabile Verbindung handelt.
Dichte von Natriumsulfid g/ml
Die Dichte von Natriumsulfid variiert je nach Form. Die wasserfreie Form von Natriumsulfid hat eine Dichte von 1,856 g/ml, während die Nonahydratform eine Dichte von 1,58 g/ml hat. Die Dichte eines Stoffes ist die Masse pro Volumeneinheit und eine nützliche Größe zur Bestimmung der Konzentration einer Lösung.
Molekulargewicht von Natriumsulfid
Das Molekulargewicht von Natriumsulfid beträgt 78,045 g/mol. Das bedeutet, dass ein Mol Natriumsulfid 6,022 x 10^23 Moleküle der Verbindung enthält. Das Molekulargewicht ist eine Größe, die zur Berechnung der Menge einer Substanz, die für eine Reaktion benötigt wird, sowie zur Bestimmung der Molmasse einer Verbindung nützlich ist.
Struktur von Natriumsulfid
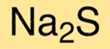
Natriumsulfid hat in seiner wasserfreien Form eine kristalline Struktur. Die Verbindung bildet farblose Kristalle, die in Wasser gut löslich sind. Die Struktur der Verbindung besteht aus Natriumkationen (Na+) und Sulfidanionen (S2-). Die Verbindung weist eine starke ionische Bindung zwischen Natrium- und Sulfidionen auf.
Natriumsulfid-Formel
Die chemische Formel für Natriumsulfid lautet Na2S. Das bedeutet, dass jedes Natriumsulfidmolekül zwei Natriumkationen und ein Sulfidanion enthält. Die Formel ist nützlich, um die chemische Zusammensetzung der Verbindung zu verstehen und ihre Eigenschaften zu bestimmen.
| Aussehen | Gelber bis gelbbrauner Feststoff, zerfließend |
| Spezifisches Gewicht | 1,856 (wasserfrei), 1,58 (Nonahydrat) |
| Farbe | Farblos bis gelb |
| Geruch | Geruch nach faulen Eiern |
| Molmasse | 78,045 g/Mol |
| Dichte | 1,856 g/ml (wasserfrei), 1,58 g/ml (Nonahydrat) |
| Fusionspunkt | 1180 °C (2156 °F) |
| Siedepunkt | >1180°C (2156°F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Ethanol, Glycerin |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Alkalisch, pH ~12 |
Sicherheit und Gefahren von Natriumsulfid
Natriumsulfid kann mehrere Sicherheitsrisiken bergen. Es reagiert sehr stark mit Wasser und kann bei Kontakt schwere Haut- und Augenreizungen verursachen. Das Einatmen der Verbindung kann zu Reizungen der Atemwege und bei Verschlucken zu Übelkeit, Erbrechen und Durchfall führen. Die Verbindung ist zudem leicht entzündlich und kann heftig mit Oxidationsmitteln reagieren. Es ist wichtig, vorsichtig mit Natriumsulfid umzugehen und geeignete Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Auch beim Umgang mit der Masse ist auf ausreichende Belüftung zu achten. Bei Exposition sollte sofort ein Arzt aufgesucht werden.
| Gefahrensymbole | Ätzend, giftig |
| Sicherheitsbeschreibung | Staub/Rauch/Gas/Nebel/Dampf/Aerosol nicht einatmen. Schutzhandschuhe/Schutzkleidung/Augenschutz/Gesichtsschutz tragen. BEI EINATMEN: Das Opfer an die frische Luft bringen und in einer Position ruhigstellen, die das Atmen erleichtert. BEI KONTAKT MIT DEN AUGEN: Einige Minuten lang vorsichtig mit Wasser spülen. Entfernen Sie Kontaktlinsen, falls vorhanden und einfach möglich. Spülen Sie weiter. BEI BERÜHRUNG MIT DER HAUT (oder dem Haar): Alle kontaminierten Kleidungsstücke sofort ausziehen. Haut mit Wasser abspülen/duschen. BEI VERSCHLUCKEN: Mund ausspülen. KEIN Erbrechen herbeiführen. Rufen Sie sofort ein GIFTINFORMATIONSZENTRUM oder einen Arzt an. |
| AN-Kennungen | UN1849 |
| HS-Code | 2830.10.00 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig; kann bei Verschlucken schwere Haut- und Augenreizungen, Reizungen der Atemwege, Übelkeit, Erbrechen und Durchfall verursachen. Kann bei Verschlucken tödlich sein. |
Methoden zur Synthese von Natriumsulfid
Es gibt mehrere Methoden zur Synthese von Natriumsulfid:
Eine übliche Methode besteht darin, Natriumhydroxid (NaOH) mit Schwefel (S) in einem Hochtemperaturofen zu reagieren, um Natriumsulfid (Na2S) und Wasser (H2O) zu erzeugen.
Eine andere Methode beinhaltet die Reaktion von Schwefeldioxid (SO2) mit Natriumsulfid (Na2S) zu Natriumthiosulfat (Na2S2O3) und die anschließende Reaktion mit Natriumhydroxid (NaOH) zu Natriumnatriumsulfid (Na2S) und Wasser (H2O).
Eine dritte Methode beinhaltet die Reduktion von Natriumsulfat (Na2SO4) mit Kohlenstoff in Gegenwart von Holzkohle bei hohen Temperaturen, um Natriumsulfid (Na2S), Kohlendioxid (CO2) und Kohlenmonoxid (CO) zu erzeugen.
Eine andere Methode besteht darin, Natriumcarbonat (Na2CO3) mit Schwefel (S) in Gegenwart von Holzkohle bei hohen Temperaturen zu reagieren, um Natriumsulfid (Na2S), Kohlendioxid (CO2) und Kohlenmonoxid zu erzeugen. Kohlenstoff (CO).
Um Natriumsulfid zu synthetisieren, kann Natriumsulfid-Nonahydrat (Na2S.9H2O) mit Schwefelsäure (H2SO4) umgesetzt werden, um Natriumsulfat (Na2SO4) und Schwefeldioxid (SO2) zu erzeugen. Erhitzen Sie dann das Natriumsulfat mit Holzkohle, um Natriumsulfid (Na2S) und Kohlendioxid (CO2) zu erzeugen.
Insgesamt gibt es unterschiedliche Methoden zur Synthese von Natriumsulfid, und die Wahl einer bestimmten Methode hängt von Faktoren wie der gewünschten Reinheit, Menge und Kosteneffizienz des Produkts ab.
Verwendung von Natriumsulfid
Natriumsulfid dient verschiedenen Industrien mit einem breiten Anwendungsspektrum.
In der Lederindustrie wird es üblicherweise als Enthaarungsmittel zur Entfernung von Haaren und Wolle aus Häuten und Fellen eingesetzt.
Es wird als Schwefelungsmittel zur Herstellung von Schwefelfarbstoffen für Textilien und als Reduktionsmittel bei der Herstellung anderer Chemikalien wie Natriumhydrosulfit verwendet.
In der Zellstoff- und Papierindustrie dient Natriumsulfid als Bleichmittel und hilft, Lignin aus Zellstoff zu entfernen.
Es wird auch als Flotationsmittel im Bergbau verwendet, um Kupfer-, Blei- und Zinkerze von ihrem Ganggestein zu trennen.
In der Abwasseraufbereitungsindustrie wird Natriumsulfid als Reduktionsmittel zur Entfernung von Schwermetallen aus Abwasserströmen verwendet. Darüber hinaus hilft es als Entchlorungsmittel bei der Entfernung von Restchlor bei Wasseraufbereitungsprozessen.
Die Pharmaindustrie verwendet Natriumsulfid bei der Herstellung bestimmter Medikamente und als Reduktionsmittel bei Reaktionen der organischen Chemie.
Laboratorien verwenden es als Reagenz in der analytischen Chemie und als Schwefelionenquelle in der chemischen Synthese.
Insgesamt ist Natriumsulfid eine vielseitige Verbindung mit vielfältigen Anwendungen in verschiedenen Branchen. Aufgrund seiner einzigartigen chemischen Eigenschaften eignet es sich unter anderem als Reduktionsmittel, Enthaarungsmittel, Flotationsmittel und Entchlorungsmittel.
Fragen:
F: Welche Ladung hat das Kation in der ionischen Verbindung Natriumsulfid?
A: Das Kation von Natriumsulfid ist Natrium (Na+) mit einer Ladung von +1.
F: Wie lautet die Formel für Natriumsulfid?
A: Die Formel für Natriumsulfid lautet Na2S, was die ionische Verbindung darstellt, die durch die Kombination eines Natriumkations (Na+) und eines Sulfidanions (S2-) entsteht.
F: Wie lautet die Formel für Natriumsulfid?
A: Die Formel für Natriumsulfid lautet Na2S, was die ionische Verbindung darstellt, die durch die Kombination eines Natriumkations (Na+) und eines Sulfidanions (S2-) entsteht.
F: Ist Natriumsulfid löslich?
A: Natriumsulfid ist in polaren Lösungsmitteln wie Wasser und Ethanol löslich, in unpolaren Lösungsmitteln wie Benzol und Chloroform ist es jedoch unlöslich.
F: Ist Natriumsulfid wasserlöslich?
A: Ja, Natriumsulfid ist in Wasser gut löslich, mit einer Löslichkeit von etwa 50 g/100 ml bei Raumtemperatur. Wenn Natriumsulfid in Wasser gelöst wird, wird es hydrolysiert, wobei Natriumhydroxid und Schwefelwasserstoffgas entstehen.
