Natriumperoxid (Na2O2) ist ein starkes Oxidationsmittel. Es reagiert heftig mit Wasser unter Freisetzung von Sauerstoff und kann bei Kontakt brennbare Materialien entzünden. Es wird in verschiedenen chemischen Reaktionen und als Desinfektionsmittel verwendet.
| IUPAC-Name | Natriumoxid |
| Molekularformel | Na2O2 |
| CAS-Nummer | 1313-60-6 |
| Synonyme | Natriumperoxid, Natriumsuperoxid, Dinatriumdioxid, Natriumbinoxid, Natriumdioxid, NaO2, UN 1507 |
| InChI | InChI=1S/2Na.O2/c;;1-2/q2*+1;-2 |
Eigenschaften von Natriumperoxid
Natriumperoxid-Formel
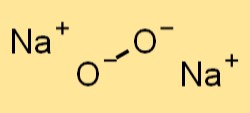
Die chemische Formel für Natriumperoxid lautet Na2O2. Es ist eine ionische Verbindung, die aus zwei Natriumkationen (Na+) und einem Peroxidanion (O22-) besteht. Die Formel für Natriumperoxid wird zur Darstellung der chemischen Zusammensetzung der Verbindung verwendet und ist wichtig für chemische Reaktionen, an denen die Substanz beteiligt ist.
Molmasse von Natriumperoxid
Natriumperoxid, chemische Formel Na2O2, hat eine Molmasse von 77,98 g/mol. Es ist eine ionische Verbindung, die aus zwei Natriumkationen (Na+) und einem Peroxidanion (O22-) besteht. Die Molmasse von Natriumperoxid ist wichtig für die Berechnung der für verschiedene chemische Reaktionen benötigten Verbindungsmenge.
Siedepunkt von Natriumperoxid
Natriumperoxid hat einen sehr hohen Siedepunkt von 657 °C (1215 °F) und ist daher bei hohen Temperaturen äußerst stabil. Die Verbindung zersetzt sich, bevor sie ihren Siedepunkt erreicht, wobei Sauerstoffgas freigesetzt wird und Natriumoxid zurückbleibt. Der hohe Siedepunkt von Natriumperoxid macht es nützlich für Hochtemperaturreaktionen und industrielle Prozesse, bei denen eine hohe thermische Stabilität erforderlich ist.
Schmelzpunkt von Natriumperoxid
Natriumperoxid hat einen Schmelzpunkt von 675 °C (1247 °F), was im Vergleich zu anderen gängigen Substanzen relativ hoch ist. Es schmilzt zu einer gelblich-weißen Flüssigkeit und zersetzt sich oberhalb seines Schmelzpunkts unter Freisetzung von Sauerstoffgas und Bildung von Natriumoxid. Der hohe Schmelzpunkt von Natriumperoxid macht es für chemische Reaktionen bei hohen Temperaturen nützlich.
Dichte von Natriumperoxid g/ml
Die Dichte von Natriumperoxid beträgt 2,805 g/ml. Es ist ein weißes bis gelbliches Pulver mit einer Dichte, die größer als die von Wasser ist. Aufgrund der hohen Dichte von Natriumperoxid eignet es sich für verschiedene industrielle Prozesse wie Bleichen, Desinfektion und die Herstellung anderer Chemikalien.
Molekulargewicht von Natriumperoxid
Natriumperoxid hat ein Molekulargewicht von 77,98 g/mol. Es ist eine ionische Verbindung mit zwei Natriumkationen (Na+) und einem Peroxidanion (O22-). Das Molekulargewicht von Natriumperoxid ist bei chemischen Reaktionen, an denen die Verbindung beteiligt ist, wichtig, da es dabei hilft, die Mengen der Reaktanten und Produkte zu bestimmen.
Struktur von Natriumperoxid
Natriumperoxid hat eine ähnliche Kristallstruktur wie Natriumchlorid (NaCl). Es bildet ein flächenzentriertes kubisches Gitter, bei dem Natriumionen die Ecken des Würfels besetzen und sich Peroxidanionen in der Mitte jeder Fläche befinden. Die Peroxidanionen in Natriumperoxid werden durch kovalente Bindungen zusammengehalten, während die Natriumionen durch ionische Bindungen zusammengehalten werden.
| Aussehen: | Weißes bis gelbliches Pulver |
| Spezifisches Gewicht: | 2.805 g/cm3 |
| Farbe: | Weiß bis gelblich |
| Geruch: | Geruchlos |
| Molmasse: | 77,98 g/Mol |
| Dichte: | 2.805 g/cm3 |
| Fusionspunkt: | 675 °C (1247 °F) |
| Siedepunkt: | 657 °C (1215 °F) |
| Flammpunkt: | Unzutreffend |
| Löslichkeit in Wasser: | Reagiert heftig mit Wasser |
| Löslichkeit: | Löslich in Alkohol, Ether |
| Dampfdruck: | Unzutreffend |
| Wasserdampfdichte: | Unzutreffend |
| pKa: | Unzutreffend |
| PH: | Unzutreffend |
Sicherheit und Gefahren von Natriumperoxid
| Gefahrensymbole: | Oxidierend, ätzend |
| Sicherheitsbeschreibung: | Staub/Rauch/Gas/Nebel/Dämpfe nicht einatmen. Kontakt mit Haut/Augen vermeiden. Unter Inertgas handhaben und lagern. Bei Augenkontakt sofort mit reichlich Wasser spülen und einen Arzt aufsuchen. Im Brandfall geeignete Löschmittel verwenden. |
| UN-Identifikationsnummern: | UN1503 |
| HS-Code: | 2829.11.00 |
| Gefahrenklasse: | 5.1 |
| Verpackungsgruppe: | II |
| Toxizität: | Ätzend für Augen und Haut, gesundheitsschädlich bei Verschlucken oder Einatmen. |
Methoden zur Synthese von Natriumperoxid
Die Synthese von Natriumperoxid (Na2O2) ist durch verschiedene Methoden möglich, beispielsweise durch direkte Kombination, Reaktion mit Sauerstoff und Elektrolyse.
Eine Methode zur Synthese von Na2O2 ist die direkte Kombinationsmethode. Dabei wird Natriummetall mit überschüssigem Sauerstoff in einem Ofen erhitzt. Die Reaktion ist exotherm und es ist wichtig, die Temperatur zu regulieren, um eine Überhitzung und eine mögliche Explosion zu vermeiden.
Eine andere Methode beinhaltet die Reaktion von Natriumhydroxid mit Wasserstoffperoxid zur Herstellung von Na2O2 und Wasser. Diese Methode ist sicherer und kontrollierter als die direkte Kombinationsmethode, erfordert jedoch eine höhere Temperatur und eine längere Reaktionszeit.
Eine andere Methode zur Synthese von Na2O2 ist die Elektrolyse. Hierbei handelt es sich um die Elektrolyse einer Natriumhydroxidlösung mithilfe einer geeigneten Anode und Kathode. Bei der Elektrolyse produziert die Kathode Na2O2, während die Anode Sauerstoffgas produziert.
Verwendung von Natriumperoxid
Natriumperoxid findet aufgrund seiner oxidierenden Eigenschaften und der Fähigkeit, Sauerstoff freizusetzen, verschiedene industrielle und Laboranwendungen.
Hier sind einige häufige Anwendungen von Natriumperoxid:
- Bleichmittel: Wird als Bleichmittel für Papierzellstoff, Textilien und andere Materialien verwendet.
- Desodorierungsmittel: Wird als Desodorierungsmittel in Abfallentsorgungs- und Abwasseraufbereitungsanlagen verwendet.
- Oxidationsmittel: Wird zur Oxidation verschiedener organischer und anorganischer Verbindungen verwendet.
- Polymerisation: Initiieren Sie die Polymerisation bestimmter Monomere. Wird bei der Herstellung von Polyurethanschaum und anderen Polymeren verwendet.
- Pharmazeutische Anwendungen: Wird als Reagenz bei der Synthese pharmazeutischer Verbindungen verwendet.
- Laborreagenz: Wird als Laborreagenz für verschiedene analytische und synthetische Zwecke verwendet.
- Brennstoffzellenanwendungen: Wird als Oxidationsmittel in Brennstoffzellen zur Erzeugung elektrischer Energie verwendet.
Fragen:
F: Wie läuft die chemische Reaktion zwischen Wasserstoffperoxid und Natriumbisulfit ab?
A: Die chemische Reaktion zwischen Wasserstoffperoxid und Natriumbisulfit erzeugt Wasser und Natriumsulfat. Die ausgeglichene Gleichung für die Reaktion lautet: 2 NaHSO3 + H2O2 → Na2SO4 + 2 H2O.
F: Wo kann man Natriumperoxidpulver kaufen?
A: Natriumperoxidpulver kann bei verschiedenen Chemikalienlieferanten und -händlern erworben werden. Es ist wichtig sicherzustellen, dass der Lieferant seriös ist und die richtigen Sicherheitsprotokolle für die Handhabung und den Versand gefährlicher Chemikalien befolgt.
F: Kann Natriumoxid in Borhydrid und Wasserstoffperoxid umgewandelt werden?
A: Natriumoxid kann nicht direkt aus Borhydrid und Wasserstoffperoxid hergestellt werden. Natriumoxid kann durch die Reaktion von Natriummetall mit Sauerstoff oder durch Erhitzen von Natriumhydroxid synthetisiert werden. Borhydrid und Wasserstoffperoxid werden bei der Synthese von Natriumoxid üblicherweise nicht verwendet.
F: Wie lautet die Formel für Natriumperoxid?
A: Die Formel für Natriumperoxid ist Na2O2.
F: Welchen Oxidationszustand hat Na2O2?
A: Die Oxidationsstufe von Natrium in Na2O2 ist +1 und die Oxidationsstufe von Sauerstoff ist -1.
F: Wie hoch ist die Oxidationszahl von Sauerstoff in der Verbindung Na2O2?
A: Die Oxidationszahl des Sauerstoffs in der Verbindung Na2O2 beträgt -1.
