Natriumethoxid ist eine starke Base, die durch die Reaktion von Natrium mit Ethanol entsteht. Es wird in der organischen Synthese verwendet, um Reaktionen wie Veresterung und Deprotonierung zu erleichtern.
| IUPAC-Name | Natriumethoxid |
| Molekularformel | C2H5NaO |
| CAS-Nummer | 141-52-6 |
| Synonyme | Ethanol, Natriumsalz; Natriumethoxid; Ethylnatrium; Ethylat; Natriumethylalkoholat |
| InChI | InChI=1S/C2H5O.Na/c1-2-3;/h2-3H,1H3;/q-1;+1 |
Eigenschaften von Natriumethoxid
Natriumethoxid-Formel
Die chemische Formel für Natriumethoxid lautet C2H5NaO. Es besteht aus zwei Kohlenstoffatomen (C), fünf Wasserstoffatomen (H), einem Natriumatom (Na) und einem Sauerstoffatom (O). Die Formel gibt das Verhältnis der in einem Natriumethoxidmolekül vorhandenen Atome an.
Molmasse von Natriumethoxid
Die Molmasse von Natriumethoxid wird durch Addition der Atommassen aller Atome in seiner Formel berechnet. Natrium (Na) hat eine Molmasse von 22,99 g/mol, Kohlenstoff (C) hat eine Molmasse von 12,01 g/mol, Wasserstoff (H) hat eine Molmasse von 1,01 g/mol mol und Sauerstoff (O) hat eine Molmasse Masse von 1,01 g/mol. Masse von 16,00 g/mol. Ihre Zugabe ergibt eine Molmasse von etwa 68,06 g/mol für Natriumethoxid.
Siedepunkt von Natriumethoxid
Natriumethoxid hat einen Siedepunkt von etwa 90–95 °C (194–203 °F). Diese Temperatur gibt den Punkt an, an dem Natriumethoxid beim Erhitzen unter normalem Atmosphärendruck von der flüssigen Phase in die gasförmige Phase übergeht.
Schmelzpunkt von Natriumethoxid
Der Schmelzpunkt von Natriumethoxid liegt bei etwa 260–270 °C (500–518 °F). Damit ist die Temperatur gemeint, bei der festes Natriumethoxid in einen flüssigen Zustand übergeht.
Dichte von Natriumethoxid g/ml
Natriumethoxid hat eine Dichte von etwa 0,868 g/ml. Die Dichte bezieht sich auf die Masse einer Substanz pro Volumeneinheit und kann zur Bestimmung ihrer relativen Schwere oder Leichtigkeit im Vergleich zu einem gleichen Wasservolumen verwendet werden.
Molekulargewicht von Natriumethoxid
Das Molekulargewicht von Natriumethoxid, auch Molekulargewicht genannt, beträgt etwa 68,06 g/mol. Sie wird berechnet, indem die Atommassen aller in einem Natriumethoxidmolekül vorhandenen Atome addiert werden.
Struktur von Natriumethoxid
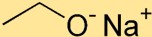
Natriumethoxid hat eine Struktur, bei der das Natriumatom (Na) durch eine ionische Bindung an das Sauerstoffatom (O) gebunden ist. An das Natriumatom ist die Ethoxidgruppe gebunden, die aus zwei Kohlenstoffatomen (C) und fünf Wasserstoffatomen (H) besteht.
Löslichkeit von Natriumethoxid
Natriumethoxid ist in polaren Lösungsmitteln wie Ethanol (C2H5OH) und anderen organischen Lösungsmitteln gut löslich. In diesen Lösungsmitteln löst es sich leicht und bildet eine klare, farblose Lösung, was seine Verwendung als Reagenz in verschiedenen organischen Reaktionen erleichtert.
| Aussehen | Farbloser Feststoff |
| Spezifisches Gewicht | 0,868 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 68,06 g/Mol |
| Dichte | 0,868 g/ml |
| Fusionspunkt | 260–270 °C (500–518 °F) |
| Siedepunkt | 90–95 °C (194–203 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert mit Wasser |
| Löslichkeit | Löslich in Ethanol (C2H5OH) und anderen organischen Lösungsmitteln |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Basisch (alkalisch) |
Sicherheit und Gefahren von Natriumethoxid
Natriumethoxid birgt mehrere Sicherheitsrisiken und daher ist beim Umgang damit Vorsicht geboten. Es handelt sich um eine ätzende Substanz, die schwere Verätzungen der Haut, Augen und Atemwege verursachen kann. Direkter Kontakt sollte vermieden werden und Handschuhe, Schutzbrillen und Schutzkleidung getragen werden. Es reagiert heftig mit Wasser und setzt brennbares Wasserstoffgas frei und sollte vor Feuchtigkeit geschützt gelagert werden. Natriumethylat kann auch heftig mit Luft reagieren, was möglicherweise zu einem Brand oder einer Explosion führen kann. Eine gute Belüftung ist entscheidend, um die Ansammlung von Dämpfen zu verhindern. Darüber hinaus ist es wichtig, mit Natriumethoxid in einem gut ausgestatteten Labor mit geschultem Personal umzugehen, um Risiken zu minimieren und die Sicherheit zu gewährleisten.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | – Verursacht schwere Verbrennungen<br>- Reagiert heftig bei Kontakt mit Wasser<br>- Vor Feuchtigkeit geschützt aufbewahren<br>- Vorsichtig handhaben<br>- Schutzausrüstung verwenden<br>- An einem trockenen Ort aufbewahren<br>- Stellen Sie sicher, dass gute Belüftung |
| UN-Identifikationsnummern | UN2922 |
| HS-Code | 2905.19.00 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Giftig bei Verschlucken oder Einatmen |
Methoden zur Synthese von Natriumethoxid
Es gibt verschiedene Methoden zur Synthese von Natriumethoxid.
Eine Möglichkeit, Natriumethoxid zu synthetisieren, beinhaltet die Reaktion zwischen metallischem Natrium und Ethanol . Metallisches Natrium geht mit wasserfreiem Ethanol eine Redoxreaktion ein, die zur Bildung von Natriumethoxid führt. Um die Reaktion durchzuführen, kann man kleine Stücke Natriummetall zu absolutem Ethanol hinzufügen und die Mischung unter kontrollierten Bedingungen unter Rückfluss kochen lassen.
Eine andere Methode beinhaltet die Reaktion zwischen Natriumhydroxid (NaOH) und Ethanol . Das Natriumhydroxid wird in Ethanol gelöst und die Mischung erhitzt, was die Reaktion zu Natriumethoxid beschleunigt. Chemiker verwenden diese Methode häufig, wenn sie die direkte Reaktion zwischen metallischem Natrium und Ethanol nicht bevorzugen.
Alternativ können sie Natriumethoxid durch die Reaktion von Ethanol mit Natriumcarbonat (Na2CO3) herstellen. Lösen Sie das Natriumcarbonat in Ethanol auf, erhitzen und rühren Sie die Mischung. Dieser Prozess führt zur Bildung von Natriumethoxid.
Es ist zu beachten, dass diese Synthesemethoden aufgrund der Reaktivität der beteiligten Chemikalien eine strikte Einhaltung von Sicherheitsvorkehrungen erfordern. Der ordnungsgemäße Umgang mit brennbaren Stoffen, die Verwendung von Schutzausrüstung und die Durchführung von Reaktionen in gut belüfteten Bereichen sind für die persönliche Sicherheit und die erfolgreiche Synthese von Natriumethoxid von entscheidender Bedeutung.
Verwendung von Natriumethoxid
Natriumethoxid findet aufgrund seiner Reaktivität und starken basischen Natur vielfältige Anwendungsmöglichkeiten. Hier sind einige häufige Verwendungszwecke:
- Organische Synthese: Natriumethoxid dient häufig als feste Basis in der organischen Synthese. Es erleichtert Reaktionen wie Veresterungs-, Kondensations- und Deprotonierungsprozesse.
- Alkoxid-Reagenz: Es dient als Alkoxid-Reagenz, das mit verschiedenen organischen Verbindungen unter Bildung von Alkoxiden reagieren kann. Diese Alkoxide sind entscheidende Zwischenprodukte in vielen organischen Reaktionen.
- Katalysator: Natriumethoxid fungiert als Katalysator bei mehreren chemischen Reaktionen. Es fördert die Umwandlung organischer Verbindungen wie Alkohole und Ester in die entsprechenden Ether oder Veresterungsprodukte.
- Dehydrierungsmittel: Es entwässert organische Verbindungen durch die Entfernung von Wassermolekülen und erleichtert so die Synthese wasserfreier Produkte.
- Polymerisation: Natriumethoxid ist an Polymerisationsreaktionen beteiligt, einschließlich der Herstellung von Polyethylenterephthalat (PET) und anderen Polyesterpolymeren.
- Pharmazeutische Herstellung: Sie findet in der pharmazeutischen Industrie Anwendung für die Synthese verschiedener pharmazeutischer Verbindungen, einschließlich Estern, Ethern und Zwischenprodukten.
- Biodieselproduktion: Der Umesterungsprozess nutzt Natriumethylat, um Pflanzenöle oder tierische Fette in Biodiesel umzuwandeln, einen erneuerbaren und umweltfreundlichen Kraftstoff.
- Laborreagenz: Forscher verwenden Natriumethoxid häufig als Reagenz für organische Reaktionen und in Versuchsaufbauten.
Fragen:
F: Basiert Natriumethoxid?
A: Ja, Natriumethoxid ist eine Base.
F: Ist Natriumethoxid eine starke oder eine schwache Base?
A: Natriumethoxid ist eine starke Base.
F: Was würden Sie erwarten, wenn dem Wasser Natriumethoxid zugesetzt würde?
A: Wenn Natriumethoxid zu Wasser gegeben wird, reagiert es heftig, setzt Wasserstoffgas frei und bildet Natriumhydroxid.
F: Ist Natriumethoxid eine starke oder eine schwache Base?
A: Natriumethoxid ist eine starke Base.
F: Ist Natriumethoxid ein starkes Nukleophil?
A: Ja, Natriumethoxid ist ein starkes Nukleophil.
F: Welche der folgenden Substanzen geht am leichtesten eine E2-Reaktion mit Natriumethoxid ein?
A: Die Verbindung mit einer primären oder sekundären Abgangsgruppe würde mit Natriumethoxid leichter eine E2-Reaktion eingehen.
F: Ist Natriumethoxid ein starkes Nukleophil?
A: Ja, Natriumethoxid ist ein starkes Nukleophil.
F: Basiert Natriumethoxid?
A: Ja, Natriumethoxid ist eine Base.
F: Welche der folgenden Substanzen geht am leichtesten eine E2-Reaktion mit Natriumethoxid (NaOCH2CH3) ein?
A: Eine Verbindung mit einer primären oder sekundären Abgangsgruppe würde leichter eine E2-Reaktion mit Natriumethoxid eingehen.
F: Ist Natriumethoxid brennbar?
A: Natriumethoxid selbst ist nicht brennbar, reagiert jedoch heftig mit Wasser und setzt brennbares Wasserstoffgas frei.
F: Was erzeugt in Kombination mit Ethanol Natriumethoxid und Wasserstoff?
A: Die Kombination von Natriummetall und Ethanol erzeugt Natriumethoxid und Wasserstoffgas.
F: Was würden Sie erwarten, wenn dem Wasser Natriumethoxid zugesetzt würde?
A: Wenn Natriumethoxid zu Wasser gegeben würde, würde es heftig reagieren, dabei Wasserstoffgas freisetzen und Natriumhydroxid bilden.
