Natriumbikarbonat (NaHCO3), auch Backpulver genannt, ist ein weißes kristallines Pulver mit leicht alkalischem Geschmack. Es wird häufig als Trennmittel beim Backen, als Reinigungsmittel und zur Behandlung von Säureverdauungsstörungen und Sodbrennen verwendet.
| IUPAC-Name | Natriumhydrogencarbonat |
| Molekularformel | NaHCO3 |
| CAS-Nummer | 144-55-8 |
| Synonyme | Backpulver, Natriumhydrogencarbonat, Natriumhydrogencarbonat |
| InChI | InChI=1S/CHNaO3/c2-1(3)4/h(H,2,3)(H2,1,2,3)/p-1 |
Eigenschaften von Natriumbicarbonat
Molmasse von Natriumbicarbonat
Die Molmasse von NaHCO3 beträgt 84,007 g/mol. Es ist die Summe der Atommassen seiner Bestandteile: Natrium, Wasserstoff, Kohlenstoff und Sauerstoff.
Siedepunkt von Natriumbicarbonat
Natriumhydrogencarbonat hat keinen festen Siedepunkt, da es sich vor dem Sieden zersetzt. Die Zersetzungstemperatur von Natriumbicarbonat liegt bei 851 °C. Dabei zerfällt es in Natriumcarbonat, Kohlendioxid und Wasser.
Schmelzpunkt von Natriumbicarbonat
Natriumhydrogencarbonat hat einen Schmelzpunkt von 50 °C, bei dem es sich von einem Feststoff in ein weißes, kristallines Pulver verwandelt.
Dichte von Natriumbicarbonat g/ml
Die Dichte von Natriumhydrogencarbonat beträgt etwa 2,165 g/ml. Dieser Wert kann je nach Korngröße und Verdichtungsgrad des Materials geringfügig variieren.
Molekulargewicht von Natriumbicarbonat
Das Molekulargewicht von Natriumbicarbonat beträgt 84,007 g/mol, berechnet aus seiner Summenformel NaHCO3.
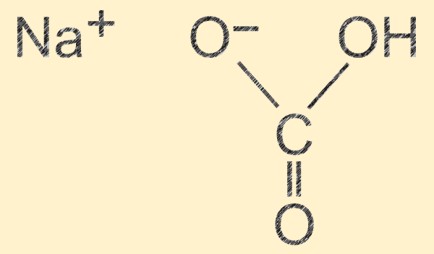
Struktur von Natriumbicarbonat
Natriumhydrogencarbonat hat eine Molekülstruktur, die aus einem Natriumion (Na+), einem Wasserstoffion (H+), einem Carbonation (CO32-) und drei Sauerstoffionen (O2-) besteht. Die Ionen sind in einer sich wiederholenden Einheit angeordnet, die eine Kristallstruktur mit einer Wasserstoffbindung zwischen den Molekülen bildet. Die ionische Natur der Verbindung verleiht ihr ihre grundlegenden Eigenschaften und die Wasserstoffbindung trägt zu ihrer physikalischen Stabilität bei.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 2.165 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 84,007 g/Mol |
| Dichte | 2.165 g/ml |
| Fusionspunkt | 50°C |
| Siedepunkt | Zersetzt sich bei 851 °C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | In Wasser löslich |
| Löslichkeit | In Wasser löslich |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 8.1 |
| pH-Wert | 8,1 (10 g/L, 25°C) |
Sicherheit und Gefahren von Natriumbicarbonat
Natriumbicarbonat ist eine sichere und häufig verwendete Verbindung mit geringer Toxizität. Es gilt im Allgemeinen als ungefährlich, nicht brennbar und nicht explosiv. Der Verzehr großer Mengen kann zu Verdauungsstörungen führen und das Risiko der Bildung von Nierensteinen erhöhen. Hautkontakt kann zu leichten Reizungen führen und das Einatmen von Staub kann zu Reizungen der Atemwege führen. Es ist wichtig, vorsichtig mit NaHCO3 umzugehen, um das Einatmen von Staub und den Kontakt mit der Haut zu vermeiden.
| Gefahrensymbole | Unzutreffend |
| Sicherheitsbeschreibung | S24/25 |
| UN-Identifikationsnummern | UN3077, UMWELTGEFÄHRLICHER STOFF, FEST, NOS (Natriumbikarbonat) |
| HS-Code | 2836.90.90 |
| Gefahrenklasse | 9 |
| Verpackungsgruppe | III |
| Toxizität | Geringe Toxizität bei Verschlucken, Einatmen oder Hautkontakt |
Methoden zur Synthese von Natriumbicarbonat
Natriumbicarbonat (NaHCO3) kann auf verschiedene Weise synthetisiert werden, einschließlich des Solvay-Verfahrens, das die am häufigsten verwendete Methode für die Produktion in großem Maßstab ist. Der Solvay-Prozess beinhaltet die Reaktion von Natriumchlorid, Ammoniak und Kohlendioxid zu Natriumhydrogencarbonat und Calciumchlorid. Natriumhydrogencarbonat kann auch durch die Reaktion von NaHCO3 und Kohlendioxid oder durch die Reaktion von Natriumhydroxid und Kohlendioxid synthetisiert werden. Diese Methoden erzeugen eine hochreine Form von NaHCO3, die durch Umkristallisation weiter gereinigt werden kann.
Verwendung von Natriumbicarbonat
Natriumhydrogencarbonat, allgemein bekannt als Backpulver, ist aufgrund seiner einzigartigen Eigenschaften vielseitig einsetzbar. Beim Kochen wird es oft als Backmittel für Backwaren wie Kuchen und Brot verwendet. In der Körperpflege wird es als mildes Schleifmittel in Zahnpasta und als Deodorant verwendet. Es wird auch in der Lebensmittelindustrie als pH-Regler und Neutralisationsmittel verwendet. Natriumhydrogencarbonat wird auch medizinisch eingesetzt, beispielsweise zur Behandlung von Sodbrennen, Verdauungsstörungen und Übersäuerung. Darüber hinaus wird es aufgrund seiner feuerlöschenden Eigenschaften bei der Herstellung von Reinigungsmitteln und Feuerlöschern verwendet. Natriumhydrogencarbonat hat auch einen Nutzen für die Umwelt, da es zur Neutralisierung saurer Abwässer verwendet werden kann.
