Natriumazid (NaN3) ist eine chemische Verbindung. Es ist hochgiftig und explosiv. Es wird in Airbags verwendet, um beim Aufprall schnell Stickstoffgas zum Aufblasen zu erzeugen.
| IUPAC-Name | Natriumazid |
| Molekularformel | NaN3 |
| CAS-Nummer | 26628-22-8 |
| Synonyme | Azium, Natriumsalz der Stickstoffwasserstoffsäure, Natriumtrinitrid |
| InChI | InChI=1S/3HNO.Na/c1-4-2;2-1-3;/h3*1H;/q;;;+1/p-1 |
Eigenschaften von Natriumazid
Natriumazid-Formel
Die Formel für Natriumazid lautet NaN3. Es besteht aus einem Natriumatom (Na) und drei Stickstoffatomen (N). Das Natriumatom ist positiv geladen, während die Stickstoffatome negativ geladen sind. Die Formel gibt das Verhältnis von Natrium- und Stickstoffatomen in der Verbindung an.
Molmasse von Natriumazid
Die Molmasse von Natriumazid wird durch Addition der Atommassen seiner Bestandteile berechnet. Natrium hat eine Molmasse von 22,99 g/mol und Stickstoff hat eine Molmasse von 14,01 g/mol. Da Natriumazid drei Stickstoffatome enthält, multiplizieren wir die Molmasse des Stickstoffs mit drei. Addiert man diese Werte, ergibt sich für Natriumazid eine Molmasse von ca. 65,01 g/mol.
Siedepunkt von Natriumazid
Natriumazid hat einen hohen Siedepunkt. Beim Erhitzen zersetzt es sich und kocht nicht. Bei Temperaturen über 275 Grad Celsius (527 Grad Fahrenheit) zerfällt es schnell in metallisches Natrium- und Stickstoffgas. Sein Siedepunkt ist daher nicht genau definiert.
Natriumazid Schmelzpunkt
Der Schmelzpunkt von Natriumazid ist im Vergleich zu seinem Siedepunkt relativ niedrig. Es schmilzt bei etwa 275 Grad Celsius (527 Grad Fahrenheit). Bei dieser Temperatur geht die Verbindung vom festen in den flüssigen Zustand über. Aufgrund seiner toxischen und explosiven Natur ist es jedoch wichtig, mit Natriumazid vorsichtig umzugehen.
Dichte von Natriumazid g/ml
Die Dichte von Natriumazid wird üblicherweise in Gramm pro Milliliter (g/ml) ausgedrückt. Die ungefähre Dichte von festem Natriumazid beträgt etwa 1,85 g/ml. Allerdings ist zu beachten, dass die Dichte je nach Faktoren wie Temperatur und Druck leicht variieren kann.
Molekulargewicht von Natriumazid
Das Molekulargewicht von Natriumazid ist die Summe der Atommassen seiner Bestandteile. Wie bereits erwähnt, besteht Natriumazid aus einem Natriumatom und drei Stickstoffatomen. Addiert man die Atommassen dieser Elemente, ergibt sich ein Molekulargewicht von etwa 65,01 Gramm pro Mol (g/mol).
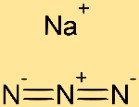
Struktur von Natriumazid
Die Struktur von Natriumazid besteht aus abwechselnden Natriumkationen (Na+) und Azidanionen (N3-). Das Natriumion ist von drei Stickstoffatomen umgeben, die jeweils ein Elektronenpaar mit dem Natriumatom teilen. Durch diese Anordnung entsteht eine stabile Kristallgitterstruktur für Natriumazid.
Löslichkeit von Natriumazid
Natriumazid ist in Wasser mäßig löslich. Es löst sich in Wasser auf und bildet eine klare Lösung. Die Löslichkeit von Natriumazid nimmt mit höheren Temperaturen zu. Aufgrund der toxischen und explosiven Natur von Natriumazid ist es jedoch wichtig, vorsichtig mit der Lösung umzugehen.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 1,85 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 65,01 g/Mol |
| Dichte | 1,85 g/ml |
| Fusionspunkt | 275°C |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Mäßig löslich |
| Löslichkeit | Löslich in polaren Lösungsmitteln wie Ammoniak |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Natriumazid
Natriumazid birgt erhebliche Sicherheitsrisiken und sollte mit äußerster Vorsicht gehandhabt werden. Es ist hochgiftig, wenn es verschluckt, eingeatmet oder über die Haut aufgenommen wird. Die Exposition gegenüber Natriumazid kann zu ernsthaften Gesundheitsrisiken führen, einschließlich Atemproblemen, Schwindel und sogar zum Tod. Es besteht außerdem eine potenzielle Explosionsgefahr, insbesondere wenn es Hitze, Stößen oder Kontakt mit bestimmten Metallen ausgesetzt ist. Bei der Arbeit mit Natriumazid sollten Personen geeignete persönliche Schutzausrüstung tragen, einschließlich Handschuhen und Schutzbrille. Es ist wichtig, diese Verbindung in gut belüfteten Bereichen, entfernt von Zündquellen und unverträglichen Substanzen, zu lagern und zu handhaben, um das Unfallrisiko zu minimieren und die Sicherheit am Arbeitsplatz zu gewährleisten.
| Gefahrensymbole | Giftig, explosiv |
| Sicherheitsbeschreibung | Mit äußerster Vorsicht umgehen. Giftiger und explosiver Stoff. |
| UN-Identifikationsnummern | UN1687 (für Natriumazid, giftige Feststoffe, anorganisch, nag) |
| HS-Code | 28500090 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | II (mäßig gefährlicher Stoff) |
| Toxizität | Sehr giftig |
Methoden zur Synthese von Natriumazid
Es gibt einige gängige Methoden zur Synthese von Natriumazid.
Eine Methode beinhaltet die Reaktion zwischen Natriumamid (NaNH2) und Stickstoffwasserstoffsäure (HN3). Bei dieser Methode löst man Natriumamid in flüssigem Ammoniak und gibt dann langsam Salzsäure hinzu. Die Reaktion findet statt und führt zur Bildung von Natriumazid und Ammoniumchlorid als Nebenprodukte.
Eine weitere Synthesemethode beinhaltet die Reaktion zwischen Natriumnitrit (NaNO2) und Natriumazid (NaN3). In einer wässrigen Lösung kontrolliert die Reaktion sorgfältig die Zugabe von Natriumnitrit zu einer Natriumazidlösung, was zur Bildung von Natriumazid und Natriumnitrat führt.
Zur Synthese von Natriumazid kann Natriumcyanid (NaCN) bei hoher Temperatur mit Lachgas (N2O) umgesetzt werden. Bei dieser Reaktion entstehen als Nebenprodukte Natriumazid und Natriumcyanat.
Befolgen Sie stets die entsprechenden Sicherheitsvorkehrungen, um die mit dem Syntheseprozess verbundenen Risiken zu minimieren. Dazu gehört die Verwendung persönlicher Schutzausrüstung und das Befolgen von Handhabungsprotokollen.
Verwendung von Natriumazid
Natriumazid hat mehrere wichtige Anwendungen in verschiedenen Branchen. Hier sind einige bemerkenswerte Apps:
- Airbag-Aufblasen: Natriumazid ist ein wichtiger Bestandteil von Auto-Airbags. Bei einer Kollision reagiert eine kleine Menge Natriumazid schnell und erzeugt Stickstoffgas, das den Airbag aufbläst und die Passagiere schützt.
- Biochemische Forschung: Forscher verwenden Natriumazid, um Enzyme wie Cytochromoxidase zu hemmen und so die Untersuchung zellulärer Prozesse und Stoffwechselwege zu erleichtern.
- Konservierung biologischer Proben: Natriumazid konserviert biologische Proben, wie z. B. Antikörper, indem es das Bakterienwachstum verhindert und ihre Stabilität aufrechterhält.
- Sprengstoffzündung: Natriumazid dient aufgrund seiner explosiven Natur als Primärsprengstoff in einigen pyrotechnischen Geräten, Zündern und Sprengstoffzündern.
- Chemische Synthese: Natriumazid fungiert als Vorstufe in verschiedenen chemischen Reaktionen und ermöglicht die Synthese organischer Verbindungen, Pharmazeutika und Farbstoffe.
- Korrosionsschutz: Industrien verwenden Natriumazid als Korrosionsinhibitor, um Metalloberflächen vor Zersetzung durch Oxidation oder Einwirkung von Korrosionsmitteln zu schützen.
- Bergbauindustrie: Natriumazid hilft bei der Trennung wertvoller Mineralien von unerwünschten Substanzen in Bergbaubetrieben als Dämpfungsmittel bei Mineralflotationsprozessen.
- Polymerindustrie: Natriumazid fungiert als Treibmittel bei der Herstellung von Polyurethanschäumen und erleichtert die Bildung von Gasblasen, die dem Schaum die gewünschte Struktur verleihen.
- Analytische Chemie: Natriumazid dient als Reagenz für verschiedene chemische Analysen, einschließlich Spektrophotometrie, Gaschromatographie und Massenspektrometrie.
- Veterinärmedizin: Tierärzte verwenden Natriumazid in einigen Fällen in der Tierarztpraxis als Mittel zur Tötung von Tieren.
Diese Anwendungen unterstreichen die vielfältigen Einsatzmöglichkeiten von Natriumazid. Aufgrund seiner toxischen und explosiven Natur ist es jedoch von entscheidender Bedeutung, mit dieser Verbindung vorsichtig umzugehen und Sicherheitsprotokolle einzuhalten.
Fragen
F: Wie testet man auf Natriumazid?
A: Natriumazid kann mit geeigneten Analysetechniken wie Spektroskopie, Chromatographie oder chemischen Reaktivitätstests getestet werden.
F: Wird Natriumazid immer noch in Airbags verwendet?
A: Ja, Natriumazid wird immer noch in Airbags als Treibmittel verwendet, um beim Aufprall ein schnelles Aufblasen zu ermöglichen.
F: Wie viele Gramm Natriumazid werden benötigt, um 30,5 g Stickstoff zu produzieren?
A: Zur Herstellung von 30,5 Gramm Stickstoffgas werden etwa 34 Gramm Natriumazid benötigt.
F: Wo kann man Natriumazid kaufen?
A: Natriumazid kann bei Chemikalienlieferanten, Laborlieferanten oder Online-Chemikalienmarktplätzen erworben werden.
F: Wie bereite ich eine Lösung von 0,01 % Natriumazid in PBS vor?
A: Um eine 0,01 %ige Natriumazidlösung in PBS herzustellen, lösen Sie 0,01 Gramm Natriumazid in 100 ml phosphatgepufferter Kochsalzlösung (PBS).
F: Welche Rolle spielt Natriumazid in den Experimenten?
A: Natriumazid wird häufig als Inhibitor oder Konservierungsmittel in Experimenten verwendet, die die Enzymaktivität hemmen oder das Bakterienwachstum verhindern sollen.
F: Wie entferne ich Natriumazid aus einer Probe?
A: Natriumazid kann durch gründliches Waschen oder Spülen mit geeigneten Lösungsmitteln oder durch Zersetzung bei hoher Temperatur aus einer Probe entfernt werden.
F: Wie wirkt sich Natriumazid auf ETC aus?
A: Natriumazid hemmt die Elektronentransportkette (ETC) in Mitochondrien, indem es das Enzym Cytochromoxidase blockiert und dadurch den Elektronenfluss und die ATP-Produktion unterbricht.
F: Wie viele Gramm Natrium entstehen, wenn 93 Gramm Natriumazid reagieren?
A: 35,9 Gramm Natrium werden gebildet, wenn 93 Gramm Natriumazid reagieren.
F: Ist die explosive Zersetzung von Natriumazid eine physikalische Veränderung bei der Airbag-Auslösung?
A: Nein, die explosive Zersetzung von Natriumazid zum Aufblasen eines Autoairbags ist eine chemische Veränderung.
F: Wie bereitet man Natriumazid zu?
A: Natriumazid wird normalerweise durch chemische Synthesemethoden hergestellt, die Reaktionen zwischen geeigneten Vorläufern wie Natriumamid und Stickstoffwasserstoffsäure umfassen.
F: Wie viel Natriumazid ist giftig?
A: Natriumazid ist hochgiftig und selbst kleine Mengen, beispielsweise einige Gramm, können erhebliche Gesundheitsrisiken darstellen, wenn sie eingenommen, eingeatmet oder über die Haut aufgenommen werden.
F: Wofür wird Natriumazid verwendet?
A: Natriumazid wird in einer Vielzahl von Anwendungen eingesetzt, darunter das Aufblasen von Airbags, die biochemische Forschung, die chemische Synthese und als Konservierungsmittel oder Inhibitor in biologischen Proben.
F: Reagiert Natriumazid mit Säuren?
A: Ja, Natriumazid kann mit Säuren wie Salzsäure (HCl) reagieren und giftige Gase wie Hydrogenazid (HN3) bilden. Beim Umgang mit Natriumazid und Säuren sind entsprechende Vorsichtsmaßnahmen zu treffen.
