Natriumamid (NaNH2) ist eine chemische Verbindung. Es besteht aus Natrium- und Stickstoffatomen. Es wird als starke Base bei verschiedenen chemischen Reaktionen verwendet.
| IUPAC-Name | Natriumamid |
| Molekularformel | NaNH2 |
| CAS-Nummer | 7782-92-5 |
| Synonyme | Natriumamid, Natriumazanid, Natriumamid, Natriumnitrid |
| InChI | InChI=1S/NaN2/c2-1-3/q-1 |
Eigenschaften von Natriumamid
Natriumamid-Formel
Die Formel für Natriumamid lautet NaNH2. Es besteht aus einem Natriumatom (Na), einem Wasserstoffatom (H) und einem Stickstoffatom (N). Diese chemische Formel stellt die Zusammensetzung von Natriumamid auf molekularer Ebene dar.
Natriumamid-Molmasse
Die Molmasse von Natriumazanid wird durch Addition der Atommassen seiner Bestandteile berechnet. Natrium hat eine Atommasse von 22,99 Gramm pro Mol (g/mol) und Stickstoff hat eine Atommasse von 14,01 g/mol. Durch Addition dieser Werte sehen wir, dass die Molmasse von Natriumazanid etwa 39 g/mol beträgt.
Siedepunkt von Natriumamid
Der Siedepunkt von Natriumazanid ist die Temperatur, bei der es vom flüssigen in den gasförmigen Zustand übergeht. Natriumazanid hat einen relativ hohen Siedepunkt von etwa 850 Grad Celsius (°C). Bei dieser Temperatur werden die intermolekularen Kräfte, die die Natriumazanidmoleküle zusammenhalten, überwunden, was zur Umwandlung vom flüssigen in den gasförmigen Zustand führt.
Natriumamid Schmelzpunkt
Der Schmelzpunkt von Natriumazanid ist die Temperatur, bei der es vom Feststoff in den flüssigen Zustand übergeht. Natriumazanid hat einen relativ niedrigen Schmelzpunkt von etwa 210 Grad Celsius (°C). Bei dieser Temperatur bricht die Kristallgitterstruktur des festen Natriumazanids zusammen, sodass sich die Partikel frei bewegen können und eine Flüssigkeit entsteht.
Dichte von Natriumamid g/ml
Die Dichte von Natriumazanid ist ein Maß für seine Masse pro Volumeneinheit. Die Dichte von Natriumazanid beträgt etwa 1,39 Gramm pro Milliliter (g/ml). Dieser Wert weist darauf hin, dass Natriumazanid eine relativ dichte Substanz ist.
Molekulargewicht von Natriumamid
Das Molekulargewicht von Natriumazanid ist die Summe der Atomgewichte aller Atome in seiner chemischen Formel. Das Molekulargewicht von Natriumazanid beträgt etwa 39 Gramm pro Mol (g/mol).
Struktur von Natriumamid
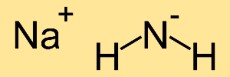
Die Struktur von Natriumazanid besteht aus einem Natriumatom (Na), das an zwei Stickstoffatome (N) gebunden ist. Die Stickstoffatome bilden eine lineare Anordnung mit dem Natriumatom in der Mitte, was zu einer linearen Molekülstruktur führt.
Löslichkeit von Natriumamid
Natriumazanid ist in Wasser schlecht löslich. Es reagiert mit Wasser unter Bildung von Natriumhydroxid (NaOH) und Ammoniak (NH3). Es ist jedoch in einigen organischen Lösungsmitteln wie flüssigem Ammoniak und flüssigen Alkoholen löslich. Die Löslichkeit von Natriumazanid in diesen Lösungsmitteln ermöglicht seinen Einsatz in verschiedenen chemischen Reaktionen.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 1,39 g/ml |
| Farbe | Weiß |
| Geruch | Ähnlich wie Ammoniak |
| Molmasse | 39 g/Mol |
| Dichte | 1,39 g/ml |
| Fusionspunkt | 210°C |
| Siedepunkt | 850°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie flüssigem Ammoniak und flüssigen Alkoholen |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Alkalisch (über 7) |
Sicherheit und Gefahren von Natriumamid
Natriumazanid birgt bestimmte Sicherheitsrisiken und Gefahren, die berücksichtigt werden müssen. Es reagiert heftig mit Wasser und setzt giftiges Ammoniakgas und ätzendes Natriumhydroxid frei. Es muss daher mit äußerster Vorsicht gehandhabt werden, um den Kontakt mit Feuchtigkeit oder Wasser zu vermeiden. Natriumazanid ist außerdem eine starke Base, die bei Kontakt mit Haut oder Augen schwere Verbrennungen und Augenschäden verursachen kann. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. Bei der Arbeit mit Natriumazanid wird empfohlen, geeignete Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske zu tragen. Ausreichende Belüftung und Lagerung entfernt von unverträglichen Substanzen sind wesentliche Sicherheitsmaßnahmen.
| Gefahrensymbole | Ätzend, schädlich, giftig |
| Sicherheitsbeschreibung | Mit äußerster Vorsicht umgehen. Kontakt mit Wasser/Feuchtigkeit vermeiden. Schutzausrüstung tragen. Eine ausreichende Belüftung und Lagerung ist erforderlich. |
| UN-Identifikationsnummern | UN 1410 |
| HS-Code | 28500020 |
| Gefahrenklasse | 4,3 (gefährlich bei Nässe), 6,1 (giftig), 8 (ätzend) |
| Verpackungsgruppe | II |
| Toxizität | Giftig bei Verschlucken, Einatmen oder Haut-/Augenkontakt |
Methoden zur Synthese von Natriumamid
Es gibt verschiedene Methoden zur Synthese von Natriumazanid.
Eine gängige Methode ist die Reaktion zwischen metallischem Natrium und gasförmigem Ammoniak (NH3) . Bei diesem Verfahren reagiert Natriummetall unter kontrollierten Bedingungen mit Ammoniakgas , um Natriumazanid zu erzeugen. Die Reaktion findet üblicherweise in einem Reaktorbehälter statt, der mit entsprechenden Sicherheitsmaßnahmen ausgestattet ist.
Eine andere Methode beinhaltet die Reaktion zwischen Natriumhydrid (NaH) und Ammoniakgas . Natriumhydrid, eine feste Verbindung, reagiert mit Ammoniakgas unter Bildung von Natriumazanid und Wasserstoffgas. Zur Durchführung dieser Reaktion werden häufig inerte Atmosphären verwendet, um unerwünschte Nebenreaktionen zu vermeiden.
Darüber hinaus ermöglicht die Reaktion zwischen metallischem Natrium und flüssigem Ammoniak die Herstellung von Natriumazanid. Bei dieser Methode wird Natriummetall in flüssigem Ammoniak gelöst, was zur Bildung von Natriumazanid und Wasserstoffgas führt.
Um Natriumazanid zu synthetisieren, reagiert Natriumazid (NaN3) mit Natriumhydroxid (NaOH). Bei der Reaktion zwischen diesen beiden Verbindungen entsteht Natriumazanid sowie die Freisetzung von Stickstoffgas.
Es ist zu beachten, dass diese Synthesemethoden aufgrund der Reaktivität und der mit Natriumazanid verbundenen Gefahren Fachwissen und entsprechende Sicherheitsvorkehrungen erfordern.
Verwendung von Natriumamid
Aufgrund seiner einzigartigen Eigenschaften findet Natriumazanid in verschiedenen Bereichen Anwendung. Hier sind einige seiner Verwendungsmöglichkeiten:
- Starke Base in Reaktionen der organischen Chemie: Natriumazanid deprotoniert schwache Säuren und erleichtert so die Synthese verschiedener organischer Verbindungen.
- Stickstoffquelle in Reaktionen: Natriumazanid führt Stickstoffatome in organische Moleküle ein und spielt eine entscheidende Rolle bei der Synthese von Arzneimitteln, Farbstoffen und Polymeren.
- Dehydrohalogenierung: Natriumazanid entfernt in Dehydrohalogenierungsreaktionen Halogenwasserstoffe aus organischen Verbindungen. Dieses Verfahren erleichtert die Herstellung von Alkenen, Alkinen und anderen ungesättigten Verbindungen.
- Ringöffnungsreaktionen: Natriumazanid ist an Ringöffnungsreaktionen zyklischer Verbindungen wie der Gabriel-Synthese beteiligt und wandelt zyklische Amine in primäre Amine um.
- Entschwefelung: Natriumazanid kann Schwefelatome aus organischen Verbindungen entfernen und so Entschwefelungsreaktionen ermöglichen. Dies ist nützlich bei der Herstellung schwefelfreier Kraftstoffe und bei der Reduzierung der Umweltbelastung durch schwefelhaltige Verbindungen.
- Wasserstoffspeicherung: Forscher untersuchten den möglichen Einsatz von Natriumazanid in Wasserstoffspeichersystemen. Es kann mit Wasserstoffgas reagieren und Natriumhydrid bilden, das dann beim Erhitzen Wasserstoff freisetzen kann.
- Katalysatorträger: Natriumazanid kann als Katalysatorträger fungieren und die Leistung bestimmter katalytischer Reaktionen verbessern. Es gewährleistet die Stabilität und verbessert die Effizienz von Katalysatoren bei verschiedenen chemischen Umwandlungen.
Insgesamt machen die vielseitigen Eigenschaften von Natriumazanid es zu einer wertvollen Verbindung in der organischen Synthese, der Stickstoffchemie und anderen industriellen Anwendungen.
Fragen:
F: Was bewirkt NaNH2?
A: NaNH2 ist eine starke Base, die häufig in Reaktionen der organischen Chemie verwendet wird, um schwache Säuren zu deprotonieren und verschiedene Umwandlungen zu erleichtern.
F: Was ist NaNH2?
A: NaNH2 ist Natriumamid, eine chemische Verbindung bestehend aus Natrium- (Na) und Azanidionen (NH2), die häufig als Reagens und starke Base in der organischen Synthese verwendet wird.
F: Wofür wird überschüssiges NaNH2 verwendet?
A: Überschüssiges NaNH2 kann zu einer zusätzlichen Deprotonierung saurer Wasserstoffatome in einer Reaktion führen, wodurch das Ausmaß der Deprotonierung erhöht und möglicherweise das Ergebnis der Reaktion verändert wird.
F: Was macht NaNH2 mit einem Alken?
A: NaNH2 kann ein Wasserstoffatom aus einem Alken extrahieren, was zur Bildung einer Alkan- und einer Natriumalkoxidverbindung führt.
F: Was macht NaNH2 mit Brombenzol?
A: NaNH2 kann das Bromatom in Brombenzol durch eine nukleophile Substitutionsreaktion ersetzen, was zur Bildung von Natriumphenylamin führt.
F: Ist NaNH2 eine starke Base?
A: Ja, NaNH2 ist eine starke Base, die aufgrund der Anwesenheit des Amidions Protonen aufnehmen und schwache Säuren deprotonieren kann.
F: Welche Reaktion findet statt, wenn H2O zu einer NaNH2/NH3-Mischung hinzugefügt wird?
A: Die Zugabe von H2O zu einer NaNH2/NH3-Mischung führt aufgrund der Reaktion zwischen Wasser und der starken Base NaNH2 zur Bildung von Ammoniakgas (NH3) und Natriumhydroxid (NaOH).
F: Welches Zwischenprodukt ist an dieser Reaktion beteiligt: NaNH2 + flüssiges NH3?
A: Das an der Reaktion von NaNH2 mit flüssigem NH3 beteiligte Zwischenprodukt ist ein solvatisiertes Elektron, das durch die Abgabe eines Elektrons von Natrium an Ammoniak entsteht.
F: Ist NaNH2 ein gutes Nukleophil?
A: Ja, NaNH2 kann aufgrund seiner Fähigkeit, ein Elektronenpaar abzugeben und an nukleophilen Substitutionsreaktionen teilzunehmen, als gutes Nukleophil wirken.
F: Ist NaNH2 ionisch oder kovalent?
A: NaNH2 ist eine ionische Verbindung, die aus positiv geladenen Natriumionen (Na+) und negativ geladenen Amidionen (NH2-) besteht.
F: Reagiert 2-Hexin mit Natriumamid?
A: Ja, 2-Hexin kann mit Natriumamid reagieren, was zur Bildung von Natriumacetylid und der entsprechenden Alkinverbindung führt.
F: Welches ist die stärkste Base unter Natriumamid und Natriumphenoxat?
A: Natriumazanid ist aufgrund der größeren Basizität des Amidions (NH2-) im Vergleich zum Phenoxion (C6H5O-) die stärkere Base als Natriumphenoxat.
