Natriumacetat (C2H3NaO2) ist eine Verbindung bestehend aus Na+- und C2H3O2–Ionen. Es wird häufig als Lebensmittelzusatzstoff und in medizinischen Anwendungen verwendet, beispielsweise in Dialyselösungen, und als Kohlenstoffquelle für bestimmte Bakterien.
| IUPAC-Name | Natriumacetat |
| Molekularformel | C2H3NaO2 |
| CAS-Nummer | 127-09-3 |
| Synonyme | Natriumsalz der Essigsäure, Natriumethanoat, Natriumacetat |
| InChI | InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Eigenschaften von Natriumacetat
Natriumacetat-Formel
Die chemische Formel für Natriumacetat lautet NaC2H3O2. Dies weist darauf hin, dass die Verbindung aus einem Na+-Ion und einem C2H3O2–Ion besteht. Das C2H3O2-Ion besteht aus einem Kohlenstoffatom, zwei Sauerstoffatomen und drei Wasserstoffatomen. Die Formel eignet sich zur Bestimmung der Stöchiometrie chemischer Reaktionen und zur Vorhersage des Verhaltens der Verbindung unter verschiedenen Bedingungen.
Molmasse von Natriumacetat
NaC2H3O2 hat eine Molmasse von 82,03 g/mol. Das bedeutet, dass ein Mol NaC2H3O2 82,03 Gramm wiegt. Die Molmasse wird durch Addition der Atommassen jedes Elements in der Verbindung berechnet. Natrium hat eine Masse von 22,99 g/mol, Kohlenstoff hat eine Masse von 12,01 g/mol, Wasserstoff hat eine Masse von 1,01 g/mol und Sauerstoff hat eine Masse von 16,00 g/mol. Die Molmasse von NaC2H3O2 ist nützlich, um die Menge der in einer bestimmten Probe vorhandenen Verbindung zu bestimmen.
Siedepunkt von Natriumacetat
NaC2H3O2 hat einen Siedepunkt von 881 °C (1.618 °F). Der Siedepunkt ist die Temperatur, bei der ein Stoff vom flüssigen in den gasförmigen Zustand übergeht. Der hohe Siedepunkt von NaC2H3O2 ist auf die starken ionischen Bindungen zwischen den Natrium- und Acetationen zurückzuführen. Bei hohen Temperaturen werden diese Bindungen aufgebrochen und die Verbindung verdampft.
Natriumacetat Schmelzpunkt
NaC2H3O2 hat einen Schmelzpunkt von 324 °C (615 °F). Der Schmelzpunkt ist die Temperatur, bei der ein Stoff vom festen in den flüssigen Zustand übergeht. Der hohe Schmelzpunkt von NaC2H3O2 ist auch auf die starken ionischen Bindungen zwischen den Natrium- und Acetationen zurückzuführen. Bei hohen Temperaturen werden diese Bindungen geschwächt und die Verbindung schmilzt.
Dichte von Natriumacetat g/ml
NaC2H3O2 hat eine Dichte von 1,45 g/ml. Die Dichte ist die Menge an Masse pro Volumeneinheit eines Stoffes. Die hohe Dichte von NaC2H3O2 ist auf die kompakte Anordnung seiner Moleküle zurückzuführen. Die Dichte von NaC2H3O2 kann je nach Konzentration in einer Lösung variieren.
Molekulargewicht von Natriumacetat
Das Molekulargewicht von NaC2H3O2 beträgt 82,03 g/mol. Es ist die Masse eines Mols der Verbindung. Das Molekulargewicht ist nützlich zur Bestimmung der Menge einer Verbindung in einer bestimmten Probe sowie zur Berechnung der Stöchiometrie chemischer Reaktionen.
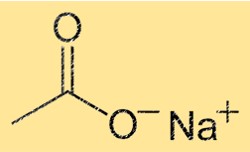
Struktur von Natriumacetat
NaC2H3O2 hat eine Kristallstruktur mit einer Wiederholungseinheit Na(CH3COO). Das bedeutet, dass jede Elementarzelle des Kristalls ein Natriumion und ein Acetation enthält. Das Na+-Ion ist von sechs Sauerstoffatomen umgeben, während das C2H3O2–Ion aus einem Kohlenstoffatom, zwei Sauerstoffatomen und drei Wasserstoffatomen besteht. Die starken Ionenbindungen zwischen den Ionen verleihen dem Kristall seine Stabilität und seine hohen Schmelz- und Siedepunkte.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 1,45 bei 20°C |
| Farbe | Farblos oder weiß |
| Geruch | Geruchlos |
| Molmasse | 82,03 g/Mol |
| Dichte | 1,45 g/cm³ bei 20°C |
| Fusionspunkt | 324 °C (615 °F) |
| Siedepunkt | 881 °C (1618 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 820 g/L (20°C) |
| Löslichkeit | Löslich in Wasser, Ethanol, Aceton |
| Dampfdruck | 1 mm Hg bei 239,2 °C |
| Wasserdampfdichte | Unzutreffend |
| pKa | 4,76 (bei 25°C) |
| pH-Wert | 7 (1%ige Lösung) |
Sicherheit und Gefahren von Natriumacetat
NaC2H3O2 gilt im Allgemeinen als sicher in der Handhabung und Verwendung, wenn die entsprechenden Vorsichtsmaßnahmen getroffen werden. Allerdings kann es zu Haut- und Augenreizungen kommen, und das Verschlucken oder Einatmen großer Mengen kann zu Magen-Darm-Reizungen, Atemproblemen und einer Depression des Zentralnervensystems führen. NaC2H3O2 kann auch mit starken Oxidationsmitteln, Säuren und Laugen reagieren und dabei Hitze und gefährliche Gase erzeugen. Beim Umgang mit NaC2H3O2 ist es wichtig, geeignete persönliche Schutzausrüstung zu tragen, einschließlich Handschuhen und Augenschutz. NaC2H3O2 sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von inkompatiblen Substanzen, gelagert werden. Bei versehentlicher Exposition oder Verschlucken sofort einen Arzt aufsuchen.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Nicht einnehmen oder einatmen. In gut belüfteten Bereichen verwenden. |
| UN-Identifikationsnummern | Nicht reguliert |
| HS-Code | 2915.21.00 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität |
Methoden zur Synthese von Natriumacetat
Es gibt verschiedene Methoden zur Synthese von NaC2H3O2, die gebräuchlichste beinhaltet jedoch die Neutralisationsreaktion von Essigsäure und Natriumhydroxid . Die Reaktionsgleichung lautet wie folgt:
CH3COOH + NaOH → CH3COONa + H2O
Zur Durchführung der Reaktion wird zunächst eine Essigsäurelösung hergestellt, indem Eisessig in Wasser gelöst wird. Geben Sie unter Rühren langsam Natriumhydroxid zur Essigsäurelösung hinzu, bis der pH-Wert der Lösung etwa 7 erreicht.
Zu diesem Zeitpunkt enthält die Lösung NaC2H3O2 und Wasser. Um festes NaC2H3O2 zu erhalten, kann die Lösung bei schwacher Hitze eingedampft werden, bis sie trocknet. Alternativ kann man die Lösung auf Raumtemperatur abkühlen lassen und die NaC2H3O2-Kristalle fallen dann von selbst aus.
Eine andere Methode zur Synthese von NaC2H3O2 beinhaltet die Reaktion zwischen Essigsäureanhydrid und Natriumcarbonat . Die Reaktionsgleichung lautet wie folgt:
2 (CH3CO)2O + Na2CO3 → 2 CH3COONa + CO2 + CO + H2O
Bei dieser Reaktion entstehen NaC2H3O2, Kohlendioxid, Kohlenmonoxid und Wasser.
Durch Eindampfen der Reaktionsmischung zur Trockne und anschließende Kristallisation in Wasser kann NaC2H3O2 in fester Form entstehen. Aufgrund der hohen Kosten von Essigsäureanhydrid wird diese Methode kaum genutzt.
Verwendung von Natriumacetat
NaC2H3O2 ist eine vielseitige Chemikalie mit vielen industriellen und wissenschaftlichen Anwendungen. Hier sind einige seiner häufigsten Verwendungszwecke:
- Puffermittel: Wird häufig als Puffermittel in chemischen und biologischen Anwendungen verwendet. Es trägt dazu bei, einen stabilen pH-Wert aufrechtzuerhalten und Säureschwankungen vorzubeugen.
- Heizkissen: Wird zur Herstellung von Heizkissen oder Heizkissen verwendet. Diese Beutel sind klein und können erwärmt werden, um einen bestimmten Bereich des Körpers mit Wärme zu versorgen.
- Lebensmittelzusatzstoff: Wird als Lebensmittelzusatzstoff verwendet, hauptsächlich als Geschmacksverstärker, pH-Regulator und Konservierungsmittel. Hersteller von verarbeiteten Lebensmitteln verwenden es normalerweise in Snacks, Saucen und Fleischprodukten.
- Textilindustrie: Wird in der Textilindustrie als Färbe- und Druckhilfsmittel verwendet. Es hilft, die Farbstoffaufnahme und Farbechtheit von Stoffen zu verbessern.
- Chemische Synthese: Wird als Reagens in verschiedenen chemischen Reaktionen verwendet. Es wandelt Alkohole in die entsprechenden Alkylhalogenide um und erzeugt aus Essigsäure Essigsäureanhydrid.
- Medizinische Anwendungen: Wird in medizinischen Anwendungen wie der Hämodialyse und als Bestandteil von Elektrolytlösungen verwendet.
- Fotografie: Wird in der Fotografie als Fixierlösung zur Entfernung unbelichteter Silberhalogenide von Fotoabzügen und Negativen verwendet.
Fragen:
F: Welchen Zweck hat Natriumacetat bei der Amidsynthese?
A: NaC2H3O2 wird in der Amidsynthese als Base zur Deprotonierung der Amingruppe des Ausgangsmaterials verwendet. Dies erleichtert die Reaktion mit der Carbonsäure zur Bildung der Amidbindung.
F: Welchen Zweck hat die Natriumacetatlösung bei der Amidsynthese?
A: NaC2H3O2-Lösung wird als basischer Katalysator bei der Amidsynthese verwendet. Es trägt dazu bei, die Amingruppe des Ausgangsmaterials zu deprotonieren, wodurch es reaktiver gegenüber der Carbonsäure wird.
F: Basiert Natriumacetat?
A: Ja, NaC2H3O2 ist eine Base. Es ist die konjugierte Base der Essigsäure und hat in Wasser gelöst einen pH-Wert von etwa 9.
F: Was ist Natriumacetat?
A: NaC2H3O2 ist ein Natriumsalz der Essigsäure mit der chemischen Formel NaCH3COO. Es ist ein weißes, geruchloses und kristallines Pulver, das in Wasser löslich ist.
F: Welchen Zweck hat die Natriumacetatlösung bei der Synthese von Acetophenetidinamid?
A: Bei der Amidsynthese von Acetophenetidin wird NaC2H3O2-Lösung als basischer Katalysator verwendet, um die Reaktion zwischen p-Phenetidin und Essigsäureanhydrid zu erleichtern. Es hilft dabei, die Amingruppe von p-Phenetidin zu deprotonieren und sie für den nukleophilen Angriff durch Essigsäureanhydrid zu aktivieren. Dies führt zur Bildung von Acetophenetidin.
