Natriumnitrit (NaNO2) ist eine chemische Verbindung, die üblicherweise als Lebensmittelkonservierungsmittel verwendet wird, um Bakterienwachstum zu verhindern und die Farbe und den Geschmack von Wurstwaren wie Speck und Hot Dogs zu verbessern.
| IUPAC-Name | Natriumnitrit |
| Molekularformel | NaNO2 |
| CAS-Nummer | 7632-00-0 |
| Synonyme | Salpetrige Säure, Natriumsalz; E250; Natriumnitrit; Natriumnitrit; Natriumnitrit; UN 1500 |
| InChI | InChI=1S/NO2.Na/c2-1-3;/q-1;+1 |
Eigenschaften von Natriumnitrit
Natriumnitrit-Formel
Die chemische Formel für Natriumnitrit lautet NaNO2. Dies weist darauf hin, dass ein Mol Natriumnitrit ein Natriumkation, ein Stickstoffatom und zwei Sauerstoffatome enthält. Die Formel wird verwendet, um die Zusammensetzung eines Stoffes darzustellen und kann zur Vorhersage der Reaktionen verwendet werden, die ein Stoff eingehen kann.
Molmasse von Natriumnitrit
NaNo2 hat eine Molmasse von 69,0 g/mol. Dies ist die Masse eines Mols NaNo2, also der Stoffmenge, die 6,02 x 10^23 einzelne Moleküle der Verbindung enthält. Die Molmasse ist eine wichtige physikalische Eigenschaft, die zur Berechnung verschiedener chemischer und physikalischer Eigenschaften einer Substanz verwendet wird.
Siedepunkt von Natriumnitrit
Der Siedepunkt von NaNo2 liegt bei 320 °C (608 °F). Dies ist die Temperatur, bei der NaNo2 von flüssig in gasförmig übergeht. Der Siedepunkt ist eine wichtige Eigenschaft, da er Einfluss darauf haben kann, wie ein Stoff in verschiedenen industriellen Anwendungen verwendet wird, beispielsweise bei der Herstellung von Farbstoffen, Pigmenten und Arzneimitteln.
Natriumnitrit Schmelzpunkt
Der Schmelzpunkt von NaNo2 beträgt 271 °C (520 °F). Dies ist die Temperatur, bei der NaNo2 vom Feststoff in den flüssigen Zustand übergeht. Der Schmelzpunkt ist eine wichtige Eigenschaft, da er die Stabilität und Reaktivität eines Stoffes bei verschiedenen Temperaturen beeinflussen kann.
Dichte von Natriumnitrit g/ml
Die Dichte von NaNo2 beträgt 2,168 g/ml. Die Dichte ist die Masse pro Volumeneinheit eines Stoffes und kann zur Bestimmung der Konzentration einer Lösung verwendet werden. Die Dichte von NaNo2 kann auch zur Bestimmung der Reinheit einer Probe verwendet werden.
Molekulargewicht von Natriumnitrit
Das Molekulargewicht von NaNo2 beträgt 69,0 g/mol. Es ist die Summe der Atomgewichte aller Atome in einem Molekül der Verbindung. Das Molekulargewicht ist eine wichtige Eigenschaft zur Berechnung verschiedener chemischer und physikalischer Eigenschaften einer Substanz.
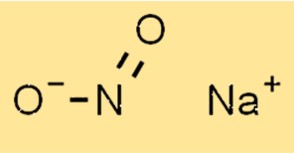
Struktur von Natriumnitrit
Die Struktur von NaNo2 besteht aus einem Natriumkation (Na+) und einem Nitritanion (NO2-). Das Nitritanion hat eine trigonal-planare Geometrie mit einem Stickstoffatom und zwei Sauerstoffatomen. Das Natriumkation befindet sich im Zentrum des Nitritanions.
Löslichkeit von Natriumnitrit
NaNo2 ist in Wasser löslich, mit einer Löslichkeit von 820 g/L bei 20 °C. Unter Löslichkeit versteht man die maximale Menge eines Stoffes, die in einer bestimmten Menge Lösungsmittel bei einer bestimmten Temperatur gelöst werden kann. Die Löslichkeit von NaNo2 kann durch Faktoren wie Temperatur und das Vorhandensein anderer gelöster Stoffe beeinflusst werden.
| Aussehen | Weißes bis leicht gelbliches kristallines Pulver |
| Spezifisches Gewicht | 2.168 g/ml |
| Farbe | Weiß bis leicht gelblich |
| Geruch | Geruchlos |
| Molmasse | 69,0 g/Mol |
| Dichte | 2.168 g/ml |
| Fusionspunkt | 271 °C (520 °F) |
| Siedepunkt | 320 °C (608 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 820 g/L bei 20°C |
| Löslichkeit | Löslich in Ethanol und Glycerin |
| Dampfdruck | 1,33 kPa bei 20°C |
| Wasserdampfdichte | 2,3 (Luft = 1) |
| pKa | 3.34 |
| pH-Wert | 7-8 (10 %ige Lösung) |
Sicherheit und Gefahren von Natriumnitrit
NaNo2 kann eine Reihe von Gefahren für die menschliche Gesundheit und die Umwelt darstellen. Es gilt als giftig, wenn es eingenommen, eingeatmet oder über die Haut aufgenommen wird, und kann Methämoglobinämie verursachen, eine Erkrankung, bei der das Blut nicht in der Lage ist, Sauerstoff in die Körpergewebe zu transportieren. NaNo2 kann auch Augen, Haut und Atemwege reizen. Es ist wichtig, mit NaNo2 vorsichtig umzugehen, geeignete persönliche Schutzausrüstung zu verwenden und ordnungsgemäße Handhabungs- und Entsorgungsverfahren zu befolgen. Darüber hinaus kann NaNo2 eine Gefahr für die Umwelt darstellen, wenn es nicht ordnungsgemäß eingedämmt und entsorgt wird.
| Gefahrensymbole | T+,C |
| Sicherheitsbeschreibung | Von brennbaren Materialien fernhalten. Staub/Rauch/Gas/Nebel/Dampf/Aerosol nicht einatmen. Tragen Sie Schutzhandschuhe/-kleidung und Augen-/Gesichtsschutz. Im Brandfall: Zum Löschen CO2, chemisches Pulver oder Schaum verwenden. Inhalt/Behälter gemäß den lokalen/regionalen/nationalen/internationalen Vorschriften entsorgen. |
| UN-Identifikationsnummern | UN1500 |
| HS-Code | 283410 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig beim Verschlucken, Einatmen und Hautabsorption. Kann Methämoglobinämie verursachen. Reizt Augen, Haut und Atemwege. |
Methoden zur Synthese von Natriumnitrit
Es gibt verschiedene Methoden zur Synthese von NaNo2.
Eine übliche Methode ist die Reaktion von Salpetersäure und Natriumhydroxid , wodurch Natriumnitrat entsteht. Ein Reduktionsmittel wie Eisen oder Zink reduziert Natriumnitrat und bildet NaNo2.
Eine andere Methode beinhaltet die Reaktion von Natriumnitrat mit Salzsäure , wodurch eine Mischung aus Salpetersäure und Natriumchlorid entsteht. Natriumhydroxid reagiert mit Salpetersäure unter Bildung von NaNo2.
Die NaNo2-Synthese kann durch die Reaktion zwischen Ammoniak und Natriumnitrat erfolgen, wobei NaNo2 und Wasser als Produkte entstehen.
Bei der Herstellung von Salpetersäure entsteht als Nebenprodukt NaNo2, während gleichzeitig Ammoniak oxidiert wird.
Verwendung von Natriumnitrit
NaNo2 wird in verschiedenen Branchen vielfältig eingesetzt, darunter:
- Lebensmittelkonservierung: Wird häufig als Lebensmittelkonservierungsmittel verwendet, insbesondere in Wurstwaren wie Speck und Hot Dogs. Es hilft, das Wachstum schädlicher Bakterien zu verhindern und die Farbe und den Geschmack von Fleisch zu bewahren.
- Industrielle Anwendungen: Wird in verschiedenen industriellen Anwendungen verwendet, beispielsweise in der Metallverarbeitung und als Korrosionsinhibitor. Wird auch bei der Herstellung von Farbstoffen und anderen Chemikalien verwendet.
- Medizinische Anwendungen: Wird medizinisch zur Behandlung einer Zyanidvergiftung verwendet, da es Hämoglobin in Methämoglobin umwandelt, das sich an Zyanidionen binden und diese daran hindern kann, sich an Hämoglobin zu binden.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung verwendet, um das Wachstum schädlicher Bakterien und Algen in Wassersystemen zu kontrollieren.
- Landwirtschaft: Wird in der Landwirtschaft als Dünger verwendet und trägt zur Verbesserung der Ernteerträge und -qualität bei.
- Fotografie: Wird in der Fotografie als Entwicklungsmittel verwendet.
Fragen:
F: Was ist Natriumnitrit?
A: NaNo2 ist eine chemische Verbindung mit der Formel NaNO2. Es ist ein weißes oder leicht gelbliches kristallines Pulver, das häufig als Lebensmittelkonservierungsmittel und in verschiedenen industriellen Anwendungen verwendet wird.
F: Wer hat Natriumnitrit entdeckt?
A: NaNO2 wurde erstmals 1805 vom französischen Chemiker Louis Nicolas Vauquelin entdeckt.
F: Ist Natriumnitrit schädlich für Sie?
A: Übermäßiger Konsum von NaNo2 kann gesundheitsschädlich sein. Es wurde mit Gesundheitsproblemen wie Krebs und Methämoglobinämie in Verbindung gebracht, einer Krankheit, bei der das Blut nicht in der Lage ist, Sauerstoff effektiv zu transportieren. Bei Verwendung in regulierten und begrenzten Mengen gilt NaNo2 jedoch als unbedenklich für den Verzehr.
F: Wie lautet die Formel für Natriumnitrit?
A: Die Formel für Natriumnitrit lautet NaNO2.
F: Ist Natriumnitrit sicher?
A: NaNo2 gilt im Allgemeinen als sicher für den Verzehr, wenn es in regulierten und begrenzten Mengen verwendet wird. Allerdings kann ein übermäßiger Verzehr schädlich für die menschliche Gesundheit sein.
F: Wie stellt man Natriumnitrit her?
A: NaNo2 kann durch verschiedene Methoden synthetisiert werden, beispielsweise durch die Reaktion von Salpetersäure und Natriumhydroxid, die Reaktion von Natriumnitrat mit Salzsäure und die Reaktion von Ammoniak mit Natriumnitrat. Allerdings muss die Synthese von NaNo2 mit Vorsicht durchgeführt werden, da sie den Einsatz gefährlicher Chemikalien erfordert und entsprechende Sicherheitsmaßnahmen erfordert.
F: Ist Natriumnitrit ein Oxidationsmittel?
A: Ja, NaNo2 ist ein Oxidationsmittel. Es wird häufig in der Pyrotechnik als Oxidationsmittel verwendet.
F: Wie beeinflusst Natriumnitrit die Farbe von Fleisch?
A: NaNO2 wird häufig als Lebensmittelkonservierungsmittel in Wurstwaren wie Speck und Hot Dogs verwendet. Es trägt dazu bei, die Farbe des Fleisches zu bewahren, indem es das Wachstum schädlicher Bakterien hemmt, die zu Verfärbungen führen können.
F: Wie werden NaNO2 und NaNO3 kommerziell hergestellt?
A: NaNO3 und NaNO2 werden kommerziell durch verschiedene Methoden hergestellt, beispielsweise durch die Oxidation von Ammoniak und die Reaktion von Natriumhydroxid mit Salpetersäure. Sie werden in verschiedenen industriellen, medizinischen und landwirtschaftlichen Anwendungen sowie bei der Lebensmittelkonservierung eingesetzt.
