Natriumchlorid (NaCl) ist eine Verbindung aus Natrium- und Chlorionen. Es wird allgemein als Speisesalz bezeichnet und zum Würzen von Speisen und zum Konservieren von Lebensmitteln verwendet.
| IUPAC-Name | Natriumchlorid |
| Molekularformel | NaCl |
| CAS-Nummer | 7647-14-5 |
| Synonyme | Halit, Steinsalz, Kochsalzlösung, Meersalz |
| InChI | InChI=1S/ClH.Na/h1H;/q;+1/p-1 |
Natriumchlorid-Formel
Die chemische Formel für Natriumchlorid lautet NaCl und stellt die Kombination eines Natriumions (Na+) und eines Chloridions (Cl-) dar. Die Formel gibt die relative Anzahl der Atome oder Ionen in der Verbindung an und ermöglicht so eine einfache Identifizierung und Darstellung ihrer Zusammensetzung.
Molmasse von NaCl
Die Molmasse von Natriumchlorid, auch Speisesalz genannt, beträgt 58,44 g/mol. Das bedeutet, dass ein Mol Natriumchlorid 58,44 Gramm der Verbindung enthält. Die Molmasse wird durch Addition der Atommassen von Natrium (Na) und Chlor (Cl) in der Verbindung berechnet, die 22,99 g/mol bzw. 35,45 g/mol betragen.
Siedepunkt von Natriumchlorid
Natriumchlorid hat aufgrund seiner ionischen Bindung einen hohen Siedepunkt von 1.413 °C (2.575 °F). Beim Erhitzen werden durch den Energieeintrag die Ionenbindungen zwischen den Natrium- und Chloridionen aufgebrochen, wodurch die Verbindung ihre Phase vom festen in den flüssigen Zustand ändert. Der Siedepunkt von Natriumchlorid ist aufgrund der starken elektrostatischen Anziehung zwischen den Ionen höher als bei vielen anderen Verbindungen.
Schmelzpunkt von Natriumchlorid
Der Schmelzpunkt von Natriumchlorid beträgt 801 °C (1474 °F). Der hohe Schmelzpunkt ist ebenso wie der Siedepunkt auf die starken Ionenbindungen zwischen Natrium- und Chloridionen zurückzuführen. Beim Erhitzen überwindet der Energieeintrag die elektrostatischen Kräfte, die die Ionen zusammenhalten, wodurch die Verbindung vom festen in den flüssigen Zustand übergeht.
Dichte von Natriumchlorid g/ml
Die Dichte von Natriumchlorid beträgt 2,165 g/ml bei Raumtemperatur (25 °C oder 77 °F). Die Dichte ist ein Maß für die Masse pro Volumeneinheit eines Stoffes. Die hohe Dichte von Natriumchlorid ist auf die kompakte Anordnung seiner Atome und die starke Ionenbindung zwischen den Natrium- und Chloridionen zurückzuführen.
Molekulargewicht von Natriumchlorid
Das Molekulargewicht von Natriumchlorid beträgt, wie bereits erwähnt, 58,44 g/mol. Das Molekulargewicht wird durch Addition der Atomgewichte aller Atome in einem Molekül berechnet. Obwohl Natriumchlorid nicht als Molekül im herkömmlichen Sinne existiert, wird sein Molekulargewicht anhand der Formeleinheit NaCl berechnet.
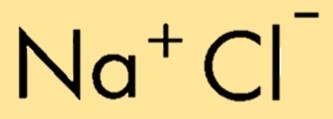
Struktur von Natriumchlorid
Natriumchlorid hat eine Kristallstruktur, die aus einer regelmäßigen Anordnung von Natrium- und Chloridionen im Verhältnis 1:1 besteht. Die Struktur ist ein flächenzentriertes kubisches Gitter, wobei jedes Natriumion von sechs Chloridionen und jedes Chloridion von sechs Natriumionen umgeben ist. Durch die Ionenbindung im Natriumchlorid entsteht eine Netzwerkstruktur, die sehr stabil und schwer zu brechen ist.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2.165 |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 58,44 g/Mol |
| Dichte | 2.165 g/ml |
| Fusionspunkt | 801 °C (1474 °F) |
| Siedepunkt | 1.413 °C (2.575 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 359 g/L bei 20°C |
| Löslichkeit | Löslich in Wasser und Glycerin; unlöslich in Ethanol und Aceton |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | 7 |
| pH-Wert | 7 (neutral) |
Sicherheit und Gefahren von Natriumchlorid
Natriumchlorid (NaCl) gilt im Allgemeinen als sicher für den menschlichen Verzehr und die Verwendung. Allerdings kann die Einwirkung hoher NaCl-Konzentrationen zu Reizungen der Augen, der Haut und der Atemwege führen. Die Einnahme großer Mengen NaCl kann zu Dehydrierung, Elektrolytstörungen und sogar zum Tod führen. Natriumchlorid kann bei Kontakt mit brennbaren Materialien auch eine Brand- und Explosionsgefahr darstellen. Um Unfälle zu vermeiden, sind eine ordnungsgemäße Handhabung und Lagerung erforderlich. Es ist wichtig, bei der Handhabung und Verwendung von NaCl die richtigen Richtlinien und Sicherheitsvorkehrungen zu befolgen, um das Risiko einer Beschädigung zu minimieren.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Gesundheitsschädlich beim Verschlucken oder Einatmen. Verursacht Haut- und Augenreizungen. |
| UN-Identifikationsnummern | UN 7646 |
| HS-Code | 2501.00.90 |
| Gefahrenklasse | Ungiftig |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | LD50 (oral, Ratte) – 3.000 mg/kg |
Methoden zur Synthese von Natriumchlorid
Natriumchlorid kann aus verschiedenen Quellen stammen, darunter Salzminen und Meerwasser, es ist aber auch möglich, es im Labor durch chemische Reaktionen zu synthetisieren.
Eine übliche Methode zur Synthese von Natriumchlorid beinhaltet die Reaktion von Salzsäure (HCl) und Natriumhydroxid (NaOH) . Bei dieser Reaktion entstehen als Nebenprodukte Natriumchlorid und Wasser. Die Gleichung für diese Reaktion lautet:
HCl + NaOH → NaCl + H2O
Eine andere Methode besteht darin, Natriumcarbonat (Na2CO3) mit Salzsäure (HCl) zu reagieren, um Natriumchlorid, Kohlendioxid und Wasser zu erzeugen. Die Gleichung für diese Reaktion lautet:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
Die Reaktion zwischen Natrium und Chlorgas ist eine dieser Methoden zur Synthese von Natriumchlorid. Diese Reaktion erfordert hohe Temperaturen und eine sorgfältige Kontrolle, um die Bildung unerwünschter Nebenprodukte zu vermeiden. Die Gleichung für diese Reaktion lautet:
2Na + Cl2 → 2NaCl
Chemiker können sich dafür entscheiden, Natriumchlorid-Synthesemethoden basierend auf Faktoren wie Kosten, Verfügbarkeit von Reagenzien und der gewünschten Reinheit und Ausbeute des Endprodukts zu modifizieren oder zu variieren. Diese Methoden stellen die Produktion von Natriumchlorid sicher, auch wenn natürliche Quellen selten sind.
Verwendung von Natriumchlorid
Natriumchlorid, auch als Speisesalz bekannt, hat vielfältige Einsatzmöglichkeiten in verschiedenen Branchen und Anwendungen. Einige der häufigsten Anwendungen von Natriumchlorid sind:
- Lebensmittelindustrie: Wird als Gewürz und Geschmacksverstärker in verschiedenen Lebensmitteln verwendet, darunter Snacks, verarbeitetes Fleisch und Backwaren.
- Medizinische Industrie: Wird in intravenösen Lösungen und anderen medizinischen Behandlungen verwendet, um die Flüssigkeiten und Elektrolyte des Körpers wieder aufzufüllen.
- Chemische Industrie: Wird zur Herstellung verschiedener Chemikalien verwendet, darunter Chlor, Natriumhydroxid und Natriumcarbonat.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung verwendet, um Verunreinigungen zu entfernen und es zum Trinken geeignet zu machen.
- Landwirtschaft: Wird als Dünger für Nutzpflanzen verwendet, insbesondere in Gebieten, in denen es dem Boden an essentiellen Nährstoffen mangelt.
- Enteisung: Wird im Winter als Enteisungsmittel auf Straßen und Gehwegen eingesetzt, um Unfälle durch rutschigen Untergrund zu verhindern.
- Textilindustrie: Wird zur Herstellung synthetischer Fasern wie Nylon und Polyester verwendet.
- Öl- und Gasindustrie: Wird beim Bohren und Fördern von Öl und Gas verwendet.
- Nutztiere: Wird als Nahrungsergänzungsmittel für Nutztiere verwendet, um ein gesundes Wachstum und eine gesunde Entwicklung zu fördern.
Dies sind nur einige Beispiele für die vielfältigen Einsatzmöglichkeiten von Natriumchlorid. Seine Vielseitigkeit und Verfügbarkeit machen es zu einem wesentlichen Bestandteil vieler Produkte und Prozesse in einer Vielzahl von Branchen.
Fragen:
F: Ist Natriumchlorid eine Verbindung?
A: Ja, Natriumchlorid ist eine Verbindung.
F: Ist Natriumchlorid ionisch oder kovalent?
A: Natriumchlorid ist eine ionische Verbindung.
F: Was ist Natriumchlorid?
A: Natriumchlorid ist eine weiße kristalline Verbindung mit der chemischen Formel NaCl. Es wird allgemein als Speisesalz bezeichnet und ist für die Ernährung von Mensch und Tier unerlässlich.
F: Wofür wird Natriumchlorid verwendet?
A: Natriumchlorid findet vielfältige Einsatzmöglichkeiten in verschiedenen Branchen und Anwendungen, unter anderem als Gewürz und Geschmacksverstärker in Lebensmitteln, zur medizinischen Behandlung, in der chemischen Produktion, bei der Wasseraufbereitung, als Enteisungsmittel, in Textilien und Erdöl. und Gas sowie als Futterergänzung für Nutztiere.
F: Ist Natriumchlorid wasserlöslich?
A: Ja, Natriumchlorid ist gut wasserlöslich.
