Hydrazin oder N2H4 ist eine farblose, hochreaktive Verbindung aus Stickstoff und Wasserstoff. Es wird als Raketentreibstoff, in Arzneimitteln und Agrarchemikalien sowie als Reduktionsmittel bei chemischen Reaktionen verwendet.
| IUPAC-Name | Hydrazin |
| Molekularformel | N2H4 |
| CAS-Nummer | 302-01-2 |
| Synonyme | Diamin; Diazan; Stickstoffhydrid; Wasserfreies Hydrazin; Wasserfreies Hydrazin; Hydraziniumhydroxid; Hydrazin hydratisiert; Methylhydrazin; Symmetrisches Hydrazin |
| InChI | InChI=1S/H4N2/c1-2/h2H,1H2 |
Lewis-Struktur N2H4:
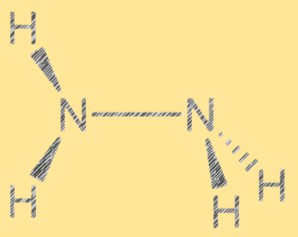
Die Lewis-Struktur von Hydrazin zeigt die Anordnung der Elektronen im Molekül. Die Struktur besteht aus zwei Stickstoffatomen mit jeweils einem freien Elektronenpaar und vier Wasserstoffatomen. Die beiden Stickstoffatome sind durch eine einzelne kovalente Bindung verbunden und jedes Stickstoffatom ist außerdem mit zwei Wasserstoffatomen verbunden. Die Lewis-Struktur von Hydrazin hilft, seine Reaktivität und Eigenschaften zu erklären.
Name der Verbindung N2H4:
Der Name der Verbindung N2H4 ist Hydrazin. Der Name leitet sich von der Tatsache ab, dass Hydrazin eine Verbindung ist, die Wasserstoff- und Stickstoffatome enthält. Hydrazin ist auch unter verschiedenen anderen Namen bekannt, darunter Diamin, Diazan und Stickstoffhydrid.
Molmasse N2H4:
Die Molmasse von Hydrazin mit der Summenformel N2H4 beträgt 32,04 g/mol. Es ist eine relativ leichte Verbindung, die aus zwei Stickstoffatomen und vier Wasserstoffatomen besteht. Die geringe Molmasse von Hydrazin ist einer der Gründe, warum es häufig als Raketentreibstoff verwendet wird, da es ein hohes Schub-Gewichts-Verhältnis bietet.
Siedepunkt von Hydrazin:
Hydrazin hat bei Atmosphärendruck einen Siedepunkt von 113,5 °C (236,3 °F). Aufgrund dieses niedrigen Siedepunkts kann Hydrazin leicht verdampfen, was die Handhabung gefährlich machen kann. Beim Erhitzen kann Hydrazin in Stickstoffgas und Wasserstoffgas zerfallen, was es ebenfalls gefährlich machen kann.
Schmelzpunkt von Hydrazin:
Der Schmelzpunkt von Hydrazin liegt bei -51,7 °C (-61,06 °F). Dies bedeutet, dass Hydrazin bei Raumtemperatur und -druck eine Flüssigkeit ist. Aufgrund seines niedrigen Schmelzpunkts kann es auch bei kälteren Temperaturen leicht erstarren, was die Handhabung erschweren kann.
Dichte von Hydrazin g/ml:
Die Dichte von Hydrazin beträgt 1,00 g/ml bei Raumtemperatur und -druck. Das bedeutet, dass Hydrazin etwas dichter ist als Wasser, das unter den gleichen Bedingungen eine Dichte von 1,00 g/ml hat.
Molekulargewicht von Hydrazin:
Das Molekulargewicht von Hydrazin beträgt 32,04 g/mol. Dieser Wert wird verwendet, um die Menge an Hydrazin zu berechnen, die bei chemischen Reaktionen und anderen Anwendungen benötigt wird.
Struktur von Hydrazin:
Die Struktur von Hydrazin besteht aus zwei Stickstoffatomen, die durch eine einzelne kovalente Bindung miteinander verbunden sind, wobei jedes Stickstoffatom auch mit zwei Wasserstoffatomen verbunden ist. Dadurch erhält Hydrazin eine symmetrische V-förmige Molekülstruktur. Die Struktur von Hydrazin spielt eine wichtige Rolle für seine Reaktivität und Eigenschaften.
Hydrazin-Formel:
Die chemische Formel für Hydrazin lautet N2H4. Diese Formel besagt, dass Hydrazin aus zwei Stickstoffatomen und vier Wasserstoffatomen besteht. Die Formel wird verwendet, um Hydrazin in chemischen Gleichungen und Reaktionen darzustellen.
| Aussehen | Farblose bis hellgelbe Flüssigkeit |
| Spezifisches Gewicht | 1,00 g/ml |
| Farbe | Farblos |
| Geruch | Ammoniakgeruch |
| Molmasse | 32,04 g/Mol |
| Dichte | 1,00 g/ml |
| Fusionspunkt | -51,7°C (-61,06°F) |
| Siedepunkt | 113,5 °C (236,3 °F) |
| Blitzpunkt | 38°C (100°F) |
| Löslichkeit in Wasser | Mischbar |
| Löslichkeit | Löslich in Ethanol, Diethylether, Chloroform |
| Dampfdruck | 72 mmHg bei 20°C |
| Wasserdampfdichte | 1,0 (Luft=1) |
| pKa | 8 |
| pH-Wert | Basisch (pH > 7) |
Sicherheit und Gefahren von Hydrazin
Hydrazin ist eine hochreaktive und gefährliche Verbindung, die sorgfältige Handhabung und Lagerung erfordert. Es ist giftig und kann bei Kontakt mit Haut, Augen oder Schleimhäuten schwere Verbrennungen verursachen. Das Einatmen von Hydrazindämpfen kann ebenfalls zu Reizungen der Atemwege und Lungenschäden führen und in extremen Fällen tödlich sein. Hydrazin ist außerdem brennbar und kann sich leicht entzünden, insbesondere bei Kontakt mit bestimmten Materialien wie Oxidationsmitteln. Aufgrund dieser Gefahren sollten beim Umgang mit Hydrazin entsprechende Sicherheitsvorkehrungen getroffen und persönliche Schutzausrüstung verwendet werden. Die Anwendung sollte nur in gut belüfteten Bereichen durch qualifiziertes Fachpersonal erfolgen, das über eine entsprechende Sicherheitsschulung verfügt.
| Gefahrensymbole | Totenkopf mit gekreuzten Knochen, Flamme |
| Sicherheitsbeschreibung | Nur in gut belüfteten Bereichen verwenden. Tragen Sie Handschuhe, Kleidung und Augen-/Gesichtsschutz. Kontakt mit Haut, Augen und Kleidung vermeiden. Von Hitze, Funken und Flammen fernhalten. |
| UN-Identifikationsnummern | UN 2030 |
| HS-Code | 282510 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig bei Verschlucken, Einatmen und Hautkontakt. Kann schwere Verbrennungen und Gewebeschäden verursachen. Eine langfristige Exposition kann zu Leber- und Nierenschäden führen und möglicherweise krebserregend sein. |
Hydrazin-Synthesemethoden
Hydrazin kann je nach gewünschter Reinheit und spezifischer Anwendung mit verschiedenen Methoden synthetisiert werden. Einige gängige Methoden zur Synthese von Hydrazin sind:
- Raschig-Prozess: Bei dieser Methode werden Ammoniak und Natriumhypochlorit in Gegenwart eines Katalysators wie Kupfer oder Nickel umgesetzt.
- Olin-Raschig-Prozess: Bei diesem Prozess erfolgt die Reaktion von Harnstoff und Salzsäure zur Herstellung von Hydrazinhydrat.
- Ketazin-Verfahren: Bei diesem Verfahren wird Aceton mit Ammoniak in Gegenwart eines Katalysators wie Raney-Nickel umgesetzt.
- Peroxidverfahren: Bei diesem Verfahren erfolgt die Reaktion von Wasserstoffperoxid und Ammoniak in Gegenwart eines Katalysators wie Platin oder Palladium.
- Bayer-Verfahren: Bei diesem Verfahren wird Natriumhypochlorit mit Harnstoff in Gegenwart eines Katalysators wie Kupfer oder Nickel umgesetzt.
- Houben-Hoesch-Reaktion: Bei dieser Reaktion reagiert salpetrige Säure mit Ammoniak in Gegenwart eines Reduktionsmittels wie Zink.
Jede Methode hat ihre eigenen Vor- und Nachteile, und die Wahl der Methode hängt von Faktoren wie Kosten, Ausbeute, Reinheit und Sicherheitsaspekten ab. Die Hydrazinsynthese sollte mit Vorsicht durchgeführt werden, da Hydrazin ein gefährlicher Stoff ist und bei unsachgemäßer Handhabung ein Risiko für die menschliche Gesundheit und Sicherheit darstellen kann.
Verwendung von Hydrazin
Aufgrund seiner einzigartigen chemischen Eigenschaften findet N2H4 ein breites Spektrum an industriellen, kommerziellen und militärischen Anwendungen. Zu den häufigsten Anwendungen von N2H4 gehören:
- Unternehmen nutzen N2H4 aufgrund seines hohen Energiegehalts und seiner Stabilität als Raketentreibstoff.
- N2H4 wird als Polymerisationsmittel bei der Herstellung bestimmter Polymere verwendet, darunter Nylon und Kevlar.
- Chemiker verwenden N2H4 als Reduktionsmittel bei chemischen Synthesereaktionen, insbesondere bei der Herstellung von Arzneimitteln, Pestiziden und anderen organischen Verbindungen.
- N2H4 fungiert als Reduktionsmittel bei Metallbeschichtungsprozessen, insbesondere bei der Vernickelung.
- Wasseraufbereitungsanlagen nutzen N2H4 als Sauerstofffänger, insbesondere in Kesseln und Kühltürmen.
- Fotografen verwenden N2H4 als fotografischen Entwickler, insbesondere in der Schwarzweißfotografie.
- Automobilhersteller setzen auf N2H4 als Gasgenerator in Airbagsystemen von Automobilen.
- Industrien verwenden N2H4 als Reinigungsmittel für bestimmte Geräte und Oberflächen, insbesondere in der Elektronikindustrie.
Obwohl Hydrazin viele nützliche Anwendungen hat, ist es auch ein gefährlicher Stoff und sollte mit Vorsicht gehandhabt werden. Beim Umgang mit Hydrazin sollten angemessene Sicherheitsvorkehrungen und persönliche Schutzausrüstung getroffen werden, und diese sollten nur von qualifizierten Fachkräften verwendet werden, die eine entsprechende Sicherheitsschulung erhalten haben.
Fragen:
Was ist die Oxidationszahl (Oxidationsstufe) von N in N2H4?
In N2H4 beträgt die Oxidationszahl (Oxidationsstufe) von N -2. Jedes Wasserstoffatom hat eine Oxidationszahl von +1, und da N2H4 ein neutrales Molekül ist, muss die Summe der Oxidationszahlen aller Atome gleich Null sein. Da N2H4 zwei Stickstoffatome enthält, beträgt die Gesamtoxidationszahl des Stickstoffs im Molekül -4. Daher beträgt die Oxidationszahl jedes Stickstoffatoms -2, was die Oxidationszahlen der Wasserstoffatome ausgleicht.
Wie heißt die Verbindung N2H4?
Die Verbindung N2H4 wird allgemein als Hydrazin bezeichnet.
Wie sind die Molverhältnisse von Hydrazin (n2h4) zu Wasserstoffperoxid (h2o2) und von Hydrazin zu Wasser?
Die Molverhältnisse von Hydrazin (N2H4) zu Wasserstoffperoxid (H2O2) und von Hydrazin zu Wasser können aus den ausgeglichenen chemischen Gleichungen der jeweiligen Reaktionen bestimmt werden.
Wenn Hydrazin mit Wasserstoffperoxid reagiert, entstehen Stickstoffgas (N2), Wasser (H2O) und Sauerstoffgas (O2) gemäß der folgenden ausgeglichenen Gleichung:
N2H4 + H2O2 → N2 + 2H2O + O2
Nach dieser Gleichung beträgt das Molverhältnis von Hydrazin zu Wasserstoffperoxid 1:1. Das bedeutet, dass für jedes bei der Reaktion eingesetzte Mol Hydrazin ein Mol Wasserstoffperoxid verbraucht wird.
Wenn Hydrazin mit Wasser reagiert, bildet es Hydrazinhydrat mit der chemischen Formel N2H4·H2O. Die ausgewogene chemische Gleichung für diese Reaktion lautet:
N2H4 + H2O → N2H4·H2O
Nach dieser Gleichung beträgt das Molverhältnis Hydrazin/Wasser 1:1. Das bedeutet, dass für jedes in der Reaktion eingesetzte Mol Hydrazin ein Mol Wasser verbraucht und ein Mol Hydrazinhydrat entsteht.
