n-Pentan ist ein Kohlenwasserstoff mit der Summenformel C5H12. Es wird als Lösungsmittel, Brennstoff und Treibmittel für die Schaumisolierung verwendet. Sein Siedepunkt liegt bei 36°C.
| IUPAC-Name | Pentan |
| Molekularformel | C5H12 |
| CAS-Nummer | 109-66-0 |
| Synonyme | n-Amylhydrid, Skellysolve A, Amylhydrid, Pentylhydrid, UN 1265 |
| InChI | InChI=1S/C5H12/c1-3-5-4-2/h3-5H2.1-2H3 |
Eigenschaften von n-Pentan
Siedepunkt von Pentan
Pentan hat einen Siedepunkt von 36,07 °C (97,13 °F) bei Standarddruck (1 atm). Es ist eine flüchtige und brennbare Flüssigkeit, die bei Raumtemperatur leicht verdunstet. Aufgrund seines niedrigen Siedepunkts eignet es sich als Treibmittel für Isolierschäume und als Kraftstoff für Verbrennungsmotoren.
Pentan-Formel
Die chemische Formel für Pentan lautet C5H12. Es ist ein geradkettiges Alkan und gehört zur Gruppe der Kohlenwasserstoffe. Die Formel gibt die Anzahl und Art der in einem Pentanmolekül vorhandenen Atome an. Die Formel von Pentan ist wichtig für die Bestimmung seines Verhaltens in verschiedenen Anwendungen, beispielsweise seiner Reaktivität mit anderen Substanzen.
Molmasse von Pentan
Die Molmasse von Pentan, auch normales Pentan genannt, beträgt 72,15 g/mol. Es ist ein geradkettiges Alkan und hat fünf Kohlenstoffatome und 12 Wasserstoffatome. Seine Molmasse wird durch Addition der Atomgewichte von Kohlenstoff und Wasserstoff im Molekül berechnet. Die Molmasse von Pentan ist wichtig für die Bestimmung der Menge der Verbindung, die bei verschiedenen chemischen Reaktionen benötigt wird.
Schmelzpunkt von Pentan
Pentan hat einen Schmelzpunkt von -129,8 °C (-201,6 °F). Bei Raumtemperatur und -druck ist es eine farblose Flüssigkeit, bei niedrigen Temperaturen kann es jedoch zu einem Feststoff gefrieren. Der Schmelzpunkt von Pentan ist wichtig für die Bestimmung seines Verhaltens in verschiedenen Anwendungen, beispielsweise in der Kühlung und Wärmeübertragung.
Dichte von Pentan g/ml
Die Dichte von Pentan beträgt 0,63 g/ml bei 20 °C. Es ist eine Flüssigkeit mit einer geringeren Dichte als Wasser und schwimmt auf der Wasseroberfläche. Die Dichte von Pentan ist wichtig für sein Verhalten in verschiedenen Anwendungen, beispielsweise beim Mischen mit anderen Flüssigkeiten und seiner Eignung als Kraftstoff.
Molekulargewicht von Pentan
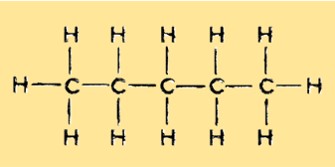
Das Molekulargewicht von Pentan beträgt 72,15 g/mol. Es ist die Summe der Atomgewichte aller Atome in einem Pentanmolekül. Das Molekulargewicht von Pentan ist wichtig für die Bestimmung seines Verhaltens in verschiedenen Anwendungen, beispielsweise seiner Löslichkeit in verschiedenen Lösungsmitteln.
Struktur von Pentan
Pentan hat eine lineare, unverzweigte Struktur mit fünf Kohlenstoffatomen und 12 Wasserstoffatomen. Es ist ein gesättigter Kohlenwasserstoff und gehört zur Alkangruppe. Jedes Kohlenstoffatom ist an zwei Wasserstoffatome gebunden, mit Ausnahme der beiden endständigen Kohlenstoffatome, die an drei Wasserstoffatome gebunden sind.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,626 – 0,63 bei 20°C |
| Farbe | Farblos |
| Geruch | Geruch nach Benzin |
| Molmasse | 72,15 g/Mol |
| Dichte | 0,63 g/ml bei 20 °C |
| Fusionspunkt | -129,8°C (-201,6°F) |
| Siedepunkt | 36,07 °C (97,13 °F) |
| Blitzpunkt | -49°C (-56,2°F) |
| Löslichkeit in Wasser | 17,5 mg/L bei 20 °C |
| Löslichkeit | Unlöslich in Wasser, löslich in organischen Lösungsmitteln |
| Dampfdruck | 380 mmHg bei 25°C |
| Wasserdampfdichte | 2,5 (Luft=1) |
| pKa | ~45 |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von n-Pentan
N-Pentan ist eine brennbare Flüssigkeit und kann mit Luft explosionsfähige Gemische bilden. Es stellt eine Brand- und Explosionsgefahr dar und sollte mit Vorsicht gehandhabt werden. Es kann zu Reizungen der Augen, der Haut und der Atemwege führen, und bei längerer Exposition kann es zu Schwindel und Kopfschmerzen kommen. Beim Umgang mit n-Pentan ist die Verwendung geeigneter persönlicher Schutzausrüstung wichtig. Im Brandfall geeignete Löschmittel wie Kohlendioxid oder Trockenlöschpulver verwenden. Es ist außerdem wichtig, n-Pentan an einem kühlen, gut belüfteten Ort und fern von Zündquellen zu lagern.
| Gefahrensymbole | F, Xi |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Verwenden Sie nur funkenfreie Werkzeuge. Halten Sie den Behälter fest verschlossen. Dämpfe nicht einatmen. Kontakt mit Augen, Haut und Kleidung vermeiden. Nur in einem gut belüfteten Bereich verwenden. Im Brandfall geeignete Löschmittel verwenden. |
| UN-Identifikationsnummern | UN1265 |
| HS-Code | 2901.10.00 |
| Gefahrenklasse | 3 |
| Verpackungsgruppe | II |
| Toxizität | Kann Augen-, Haut- und Atemwegsreizungen verursachen. Bei längerer Exposition kann es zu Schwindel und Kopfschmerzen kommen. |
Methoden zur Synthese von n-Pentan
Die Ölraffinierung ist die wichtigste Methode zur Herstellung von n-Pentan. Es ist ein geradkettiger Kohlenwasserstoff und einer der Hauptbestandteile von Benzin. Für die Synthese von n-Pentan gibt es mehrere Methoden:
Ölcracken: Um n-Pentan aus Öl zu gewinnen, können wir es durch fraktionierte Destillation knacken, einen Prozess, bei dem Rohöl erhitzt wird, um seine Bestandteile anhand ihres Siedepunkts zu trennen. Anschließend können wir n-Pentan von anderen Kohlenwasserstoffen trennen, deren Siedepunkt zwischen 30 und 40 °C liegt.
Isomerisierung: Isomerisierung ist der Prozess der Umwandlung eines Kohlenwasserstoffs in eine andere Formel mit derselben Molekülform, aber einer anderen Struktur. Bei der Isomerisierung von Pentenen entsteht als Nebenprodukt n-Pentan. Die petrochemische Industrie verwendet diese Methode häufig.
Hydrierung: Die Pentenhydrierung ist eine weitere Methode zur Synthese von n-Pentan. Um n-Pentan aus Pentenen zu synthetisieren, können wir mit Wasserstoffgas in Gegenwart eines Katalysators reagieren, bei dem es sich normalerweise um ein Metall wie Nickel oder Platin handelt. Bei der Reaktion entsteht als Nebenprodukt n-Pentan.
Dehydratisierung von 1-Pentanol: Man kann n-Pentan auch aus 1-Pentanol synthetisieren, indem man es mit einem Säurekatalysator wie Schwefelsäure dehydratisiert. Bei dieser Reaktion entsteht n-Penten, das dann hydriert werden kann, um n-Pentan zu erhalten.
Verwendung von n-Pentan
N-Pentan hat vielfältige Einsatzmöglichkeiten in verschiedenen Branchen. Hier sind einige der Hauptanwendungen:
- Lösungsmittel: Wird als Lösungsmittel für Öle, Wachse und Harze in der Farben- und Lackindustrie verwendet. Klebstoffe, Tinten und Gummi verwenden es als Lösungsmittel.
- Treibmittel: Wird als Treibmittel bei der Herstellung von Schaumisolierungen wie expandiertem Polystyrol (EPS) und extrudiertem Polystyrol (XPS) verwendet.
- Chemisches Zwischenprodukt: Wird als chemisches Zwischenprodukt bei der Herstellung anderer Chemikalien wie Pentanol, Pentansäure und Pentanal verwendet.
- Kraftstoff: Wird als Kraftstoff in einigen Benzinmischungen verwendet, normalerweise als Mischkomponente zur Erhöhung der Oktanzahl.
- Kalibrierstandard: Wird als Kalibrierstandard in der Gaschromatographie verwendet.
- Extraktion: Wird zur Gewinnung von Speiseölen wie Sojaöl und zur Gewinnung von Naturprodukten wie ätherischen Ölen aus Pflanzen verwendet.
- Laborforschung: Wird in der Laborforschung als Lösungsmittel und als Referenzmaterial für die Gaschromatographie verwendet.
Fragen:
F: Die Summenformel für Pentan lautet c5h12. Wie lautet die Summenformel eines Pentan-Isomers?
A: 2-Methylbutan (auch als Isopentan bekannt) hat die Summenformel C5H12 und ist ein Isomer von Pentan.
F: Ist Pentan polar?
A: Nein, Pentan ist unpolar, weil es nur unpolare Kohlenstoff-Kohlenstoff- und Kohlenstoff-Wasserstoff-Bindungen enthält und eine symmetrische Molekülform hat.
F: Welche der folgenden Substanzen ist am besten wasserlöslich? Essigsäure Pentanol Butansäure Pentanal
A: Essigsäure ist aufgrund ihrer Fähigkeit, Wasserstoffbrückenbindungen mit Wassermolekülen zu bilden, am besten wasserlöslich.
F: Ist Pentan wasserlöslich?
A: Nein, Pentan ist aufgrund seiner unpolaren Natur und seiner Unfähigkeit, Wasserstoffbrückenbindungen mit Wassermolekülen zu bilden, in Wasser unlöslich.
F: Hat n-Pentan eine Wasserstoffbrücke?
A: Nein, n-Pentan hat keine Wasserstoffbindung, weil ihm Wasserstoffatome fehlen, die an elektronegative Atome wie Sauerstoff, Stickstoff oder Fluor gebunden sind.
