Magnesiumoxid (MgO) ist ein weißer, pulverförmiger Feststoff, der als Baustoff und Nahrungsergänzungsmittel verwendet wird. Aufgrund seiner basischen (alkalischen) Eigenschaften wird es auch als Antazidum verwendet.
| IUPAC-Name | Magnesiumoxid |
| Molekularformel | MgO |
| CAS-Nummer | 1309-48-4 |
| Synonyme | Magnesia, Magnesit, Periklas |
| InChI | InChI=1S/MgO/c1-2 |
Magnesiumoxid-Formel
Die chemische Formel für Magnesiumoxid lautet MgO. Es stellt ein Magnesiumion (Mg2+) und ein Sauerstoffion (O2-) dar. Die Formel gibt das Verhältnis der in der Verbindung vorhandenen Elemente an und wird verwendet, um ausgewogene chemische Gleichungen für Reaktionen mit Magnesiumoxid zu erstellen.
Molmasse von Magnesiumoxid
Die Molmasse von Magnesiumoxid beträgt 40,304 g/mol. Sie wird berechnet, indem die Atommassen jedes in der Verbindung vorhandenen Elements addiert werden. Die Atommasse von Magnesium beträgt 24.305 g/mol, die von Sauerstoff 16.000 g/mol. Die Molmasse ist wichtig für die Bestimmung der Stoffmenge, die in einer bestimmten Magnesiumoxidprobe vorhanden ist.
Siedepunkt von Magnesiumoxid
Der Siedepunkt von Magnesiumoxid liegt bei 2852°C. Bei dieser Temperatur erreicht der Dampfdruck des Feststoffs den Atmosphärendruck und er beginnt zu sieden. Der hohe Siedepunkt von Magnesiumoxid ist auf seine ionische Natur zurückzuführen, die eine große Energiemenge erfordert, um die Ionen in der Gitterstruktur zu trennen.
Schmelzpunkt von Magnesiumoxid
Der Schmelzpunkt von Magnesiumoxid liegt bei 2800°C. Bei dieser Temperatur geht der Feststoff in einen flüssigen Zustand über. Der hohe Schmelzpunkt von Magnesiumoxid ist auch auf seinen ionischen Charakter und die starken Bindungen zwischen den Ionen in der Netzwerkstruktur zurückzuführen.
Dichte von Magnesiumoxid g/ml
Die Dichte von Magnesiumoxid beträgt 3,58 g/ml. Dieser Wert kann verwendet werden, um den Raum zu bestimmen, der von einer bestimmten Masse Magnesiumoxid eingenommen wird. Es handelt sich um eine charakteristische Eigenschaft der Verbindung und ist in verschiedenen Anwendungen nützlich.
Molekulargewicht von Magnesiumoxid
Das Molekulargewicht von Magnesiumoxid beträgt 40.304 g/mol. Es ist die Summe der Atomgewichte jedes in der Verbindung vorhandenen Elements. Das Molekulargewicht ist wichtig für die Bestimmung der Substanzmenge, die in einer bestimmten Magnesiumoxidprobe vorhanden ist.
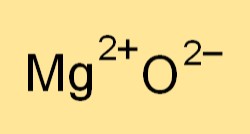
Struktur von Magnesiumoxid
Magnesiumoxid hat eine Kristallgitterstruktur, in der Magnesiumionen von Sauerstoffionen umgeben sind. Magnesium- und Sauerstoffionen werden durch starke Ionenbindungen zusammengehalten, die zu den hohen Schmelz- und Siedepunkten der Verbindung beitragen. Die Kristallstruktur ist ein wichtiger Faktor bei der Bestimmung der Eigenschaften von Magnesiumoxid, wie etwa seiner Dichte und Wärmeleitfähigkeit.
| Aussehen | Weißer, pulverförmiger Feststoff |
| Spezifisches Gewicht | 3,58 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 40,304 g/Mol |
| Dichte | 3,58 g/ml |
| Fusionspunkt | 2800°C |
| Siedepunkt | 2852°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Löslich in Säure |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Alkalisch (basisch) |
Sicherheit und Gefahren von Magnesiumoxid
Magnesiumoxid gilt in empfohlenen Dosierungen allgemein als sicher für den menschlichen Verzehr und wird als Nahrungsergänzungsmittel und Antazidum verwendet. Das Einatmen hoher Konzentrationen von Magnesiumoxidstaub kann jedoch zu Reizungen der Atemwege führen und eine langfristige Exposition kann zu Lungenschäden führen. Die Einnahme großer Mengen Magnesiumoxid kann Durchfall, Übelkeit und Bauchbeschwerden verursachen. Es ist wichtig, Magnesiumoxid an einem trockenen, gut belüfteten Ort zu lagern, um das Einatmen von Staub zu vermeiden. Vermeiden Sie Haut- und Augenkontakt mit Magnesiumoxid, da dies zu Reizungen führen kann. Wie bei allen Chemikalien ist es wichtig, bei der Arbeit mit Magnesiumoxid die richtigen Handhabungs- und Sicherheitsverfahren einzuhalten, um das Verletzungsrisiko zu minimieren.
| Gefahrensymbole | N / A |
| Sicherheitsbeschreibung | S26-S36/37/39 |
| UN-Identifikationsnummern | UN3077, Umweltgefährdende Stoffe, fest, nag (Magnesiumoxid) |
| HS-Code | 2825.90.90 |
| Gefahrenklasse | 9 |
| Verpackungsgruppe | III |
| Toxizität | Geringe Toxizität bei Einnahme in empfohlenen Dosen, kann bei Einatmen in hohen Konzentrationen zu Reizungen der Atemwege führen |
Methoden zur Magnesiumoxid-Synthese
Magnesiumoxid (MgO) kann durch verschiedene Methoden synthetisiert werden, darunter thermische Zersetzung, Fällung und Sol-Gel-Verfahren.
Bei der thermischen Zersetzung, auch Kalzinierung genannt, wird Magnesiumcarbonat oder -hydroxid auf hohe Temperaturen erhitzt, um MgO zu erzeugen. Dieses Verfahren wird häufig bei der Herstellung von feuerfesten Materialien sowie bei der Synthese von hochreinem MgO für die pharmazeutische und chemische Industrie eingesetzt.
Fällung ist eine weitere Methode zur Synthese von MgO. Bei dieser Methode werden Magnesiumsalze wie Magnesiumchlorid oder -sulfat mit einer alkalischen Lösung wie Natriumhydroxid oder Kaliumhydroxid zu MgO umgesetzt. Das ausgefällte MgO kann dann filtriert, gewaschen und getrocknet werden, um ein reines Produkt zu erhalten.
Bei Sol-Gel-Prozessen kommt es zur Hydrolyse und Kondensation von Magnesiumvorläufern wie Magnesiumalkoxiden zu MgO. Diese Methode bietet den Vorteil, MgO mit einheitlicher Partikelgröße und wohldefinierter Kristallstruktur herzustellen, was es für Anwendungen in der Katalysator-, Keramik- und Elektronikindustrie nützlich macht.
Insgesamt hängt die Methode zur Synthese von MgO von der gewünschten Reinheit, Partikelgröße und Kristallstruktur sowie der beabsichtigten Anwendung des MgO-Produkts ab. Unabhängig von der Synthesemethode ist es wichtig, die Reaktionsbedingungen sorgfältig zu kontrollieren, um die Bildung von Verunreinigungen zu vermeiden und ein hochwertiges MgO-Produkt zu erhalten.
Verwendung von Magnesiumoxid
Magnesiumoxid (Magnesiumoxid) hat aufgrund seiner chemischen Stabilität, hohen Wärmeleitfähigkeit und elektrischen Isolationseigenschaften ein breites Anwendungsspektrum. Zu den häufigsten Anwendungen für Magnesiumoxid gehören:
- Magnesiumoxid (MgO) ist aufgrund seiner chemischen Stabilität, hohen Wärmeleitfähigkeit und elektrischen Isolationseigenschaften vielseitig einsetzbar.
- Die Bauindustrie verwendet MgO als feuerbeständiges Material und bei der Herstellung von feuerfesten Materialien.
- Die Pharmaindustrie verwendet MgO als Nahrungsergänzungsmittel und Antazida zur Neutralisierung der Magensäure.
- MgO dient als Magnesiumquelle bei der Herstellung anderer Magnesiumverbindungen wie Magnesiumhydroxid und Magnesiumcarbonat.
- Die chemische Industrie nutzt MgO als Katalysator in verschiedenen Reaktionen, unter anderem bei der Herstellung von synthetischem Kautschuk, Kunststoffen und Harzen.
- Die Agrarindustrie nutzt MgO als Bodenverbesserungsmittel, um die Bodenfruchtbarkeit zu verbessern und essentielles Magnesium für das Pflanzenwachstum bereitzustellen.
- Die Fähigkeit von MgO, Schwermetalle und toxische Substanzen zu adsorbieren, macht es nützlich für die Umweltsanierung.
- Die Keramikindustrie verwendet MgO als Rohstoff bei der Herstellung von Keramik, elektrischen Isolatoren, feuerfesten Materialien und Hochtemperaturisolierungen.
- Die Elektronikindustrie verwendet MgO aufgrund seiner hohen Dielektrizitätskonstante und seines niedrigen Verlustfaktors bei der Herstellung elektronischer Geräte wie Kondensatoren und Transistoren.
Insgesamt ist Magnesiumoxid ein vielseitiges Material, das aufgrund seiner einzigartigen Kombination aus chemischen und physikalischen Eigenschaften viele Anwendungsmöglichkeiten bietet.
Fragen:
Was beschreibt eine Verbindung wie Magnesiumoxid am besten?
Magnesiumoxid (MgO) entsteht als ionische Verbindung.
Metallisches Magnesium gibt Elektronen an nichtmetallischen Sauerstoff ab und erzeugt so positiv geladene Magnesiumionen (Mg2+) und negativ geladene Oxidionen (O2-). Diese Ionen verbinden sich durch starke elektrostatische Anziehung ionisch, was zu einer festen Kristallstruktur führt.
Ionische Verbindungen weisen hohe Schmelz- und Siedepunkte, Festigkeit bei Raumtemperatur, gute elektrische Leitfähigkeit im geschmolzenen oder gelösten Zustand und Unlöslichkeit in den meisten Lösungsmitteln auf. Diese Eigenschaften unterscheiden ionische Verbindungen von molekularen Verbindungen, die durch kovalente Bindung entstehen und niedrigere Schmelz- und Siedepunkte, schlechte elektrische Leitfähigkeit und Löslichkeit in vielen Lösungsmitteln aufweisen.
Welche ionische Verbindung wird als Baustoff verwendet? Kalksteinsalz Magnesiumoxid Eisenoxid
Salzkalk ist keine ionische Verbindung, Magnesiumoxid und Eisenoxid jedoch schon.
Als Baustoffe werden Magnesiumoxid (MgO) und Eisenoxid verwendet. MgO bildet feuerfeste Wände und Trennwände und dient als Bestandteil feuerfester Materialien für Hochtemperaturanwendungen. Eisenoxid, auch Hämatit genannt, verleiht als Pigment Ziegeln, Beton und Keramik eine rotbraune Farbe. Hämatit fungiert außerdem als Katalysator bei chemischen Reaktionen und dient als magnetisches Material in verschiedenen Technologien.
