Magnesiumsulfat (Sulfat) oder MgSo4 ist eine chemische Verbindung aus Magnesium, Schwefel und Sauerstoff. Es wird häufig medizinisch als Abführmittel, Antikonvulsivum und zur Behandlung von Magnesiummangel eingesetzt.
| IUPAC-Name | Magnesiumsulfat |
| Molekularformel | MgSO4 |
| CAS-Nummer | 7487-88-9 |
| Synonyme | Bittersalz; Englisches Salz; Bitteres Salz; Badesalz; Bittersalz; Sal anglicum; Magnesiumsulfat-Heptahydrat |
| InChI | InChI=1S/Mg.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Magnesiumsulfat-Formel
Die chemische Formel für Magnesiumsulfat lautet MgSO4. Diese Formel gibt an, dass Magnesiumsulfat aus einem Magnesiumkation (Mg2+) und einem Sulfatanion (SO42-) besteht. Die Magnesiumsulfatformel ist für chemische Berechnungen wichtig, da sie dabei hilft, die Menge einer Substanz zu bestimmen, die für eine chemische Reaktion benötigt wird.
Molmasse von MgSO4
Die Molmasse von Magnesiumsulfat beträgt 120,366 g/mol. Dieser Wert errechnet sich aus der Addition der Atommassen eines Magnesiumatoms (24,305 g/mol), eines Schwefelatoms (32,066 g/mol) und vier Sauerstoffatomen (jeweils 15,999 g/mol). Die Molmasse ist ein wichtiger Parameter bei chemischen Berechnungen, da sie hilft, die Menge einer Substanz zu bestimmen, die für eine chemische Reaktion benötigt wird.
Siedepunkt von Magnesiumsulfat
Der Siedepunkt von Magnesiumsulfat hängt vom Zustand der Verbindung ab. Magnesiumsulfat gibt es in zwei Formen: wasserfrei und Heptahydrat. Die wasserfreie Form hat einen höheren Siedepunkt von 1,124 °C (2,055 °F), während die Heptahydratform einen niedrigeren Siedepunkt von 150 °C (302 °F) hat. Der Siedepunkt von Magnesiumsulfat kann durch Faktoren wie Druck und Verunreinigungen beeinflusst werden.
Schmelzpunkt von Magnesiumsulfat
Der Schmelzpunkt von Magnesiumsulfat hängt auch vom Zustand der Verbindung ab. Die wasserfreie Form hat einen höheren Schmelzpunkt von 1,124 °C (2,055 °F), während die Heptahydratform einen niedrigeren Schmelzpunkt von 150 °C (302 °F) hat. Der Schmelzpunkt von Magnesiumsulfat kann auch durch Faktoren wie Druck und Verunreinigungen beeinflusst werden.
Dichte von Magnesiumsulfat g/ml
Die Dichte von Magnesiumsulfat variiert je nach Zustand der Verbindung. Die wasserfreie Form hat eine Dichte von 2,66 g/cm³, während die Heptahydratform eine Dichte von 1,68 g/cm³ hat. Die Dichte ist eine physikalische Eigenschaft eines Stoffes, die die Menge an Masse pro Volumeneinheit angibt. Mithilfe der Dichte von Magnesiumsulfat lässt sich das Volumen eines Stoffes berechnen, das für eine chemische Reaktion benötigt wird.
Molekulargewicht von Magnesiumsulfat
Das Molekulargewicht von Magnesiumsulfat beträgt 120.366 g/mol. Dieser Wert errechnet sich aus der Addition der Atommassen eines Magnesiumatoms (24,305 g/mol), eines Schwefelatoms (32,066 g/mol) und vier Sauerstoffatomen (jeweils 15,999 g/mol). Das Molekulargewicht ist ein wichtiger Parameter bei chemischen Berechnungen, da es hilft, die Menge einer Substanz zu bestimmen, die für eine chemische Reaktion benötigt wird.
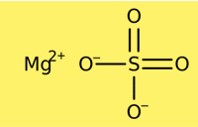
Struktur von Magnesiumsulfat
Magnesiumsulfat hat eine Kristallstruktur. Die wasserfreie Form hat eine rhomboedrische Kristallstruktur, während die Heptahydratform eine monokline Kristallstruktur aufweist. Die Kristallstruktur von Magnesiumsulfat besteht aus Magnesiumkationen und Sulfatanionen. Die wasserfreie Form enthält ein Magnesiumkation und ein Sulfatanion pro Zelle, während die Heptahydratform ein Magnesiumkation und zwei Sulfatanionen pro Zelle enthält.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,66 (wasserfrei) 1,68 (Heptahydrat) |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 120.366 g/Mol |
| Dichte | 2,66 g/cm³ (wasserfrei) 1,68 g/cm³ (Heptahydrat) |
| Fusionspunkt | 1124°C (wasserfrei) 150°C (Heptahydrat) |
| Siedepunkt | 1124°C (wasserfrei) 150°C (Heptahydrat) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 71,6g/100ml (20°C) |
| Löslichkeit | Löslich in Wasser und Ethanol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| PKa | 9,99 |
| pH-Wert | 6,0 – 8,0 (5%ige Lösung) |
Sicherheit und Gefahren von Magnesiumsulfat
Magnesiumsulfat gilt im Allgemeinen als sicher, wenn es richtig gehandhabt wird. Allerdings können bei unsachgemäßer Handhabung gewisse Gefahren entstehen. Der Kontakt mit Magnesiumsulfatstaub kann zu Reizungen der Augen, der Haut und der Atemwege führen. Die Einnahme oder Injektion großer Mengen Magnesiumsulfat kann Durchfall, Magenkrämpfe und Dehydrierung verursachen. Beim Umgang mit Magnesiumsulfat ist es wichtig, Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen, um Reizungen der Haut und Augen zu vermeiden. Bei Verschlucken oder Kontakt sofort einen Arzt aufsuchen. Magnesiumsulfat sollte an einem kühlen, trockenen Ort, entfernt von Wärmequellen und inkompatiblen Materialien, gelagert werden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | S22 – Staub nicht einatmen; S24/25 – Kontakt mit Haut und Augen vermeiden; S36 – Geeignete Schutzkleidung tragen; S26 – Bei Augenkontakt sofort mit viel Wasser spülen und einen Arzt konsultieren; S45 – Bei einem Unfall oder Unwohlsein sofort einen Arzt aufsuchen (wenn möglich, diesem das Etikett vorzeigen) |
| AN-Kennungen | UN3077 |
| HS-Code | 28332100 |
| Gefahrenklasse | 9 |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte) > 3.000 mg/kg; LD50 (kutan, Ratte) > 2.000 mg/kg |
Methoden zur Magnesiumsulfat-Synthese
Es gibt verschiedene Methoden zur Synthese von Magnesiumsulfat (MgSO4).
Eine gängige Methode ist die Reaktion von Magnesiumoxid oder Magnesiumhydroxid mit Schwefelsäure. Dabei wird Schwefelsäure unter Rühren mit Magnesiumoxid oder -hydroxid versetzt, bis sich die Mischung vollständig auflöst. Sammeln Sie die MgSO4-Magnesiumkristalle, indem Sie die Lösung verdampfen, um überschüssiges Wasser zu entfernen.
Ein anderer Ansatz besteht darin, der Schwefelsäure unter Rühren langsam Magnesiumcarbonat zuzugeben, bis es vollständig gelöst ist. Um MgSO4-Magnesiumkristalle zu erhalten, filtrieren Sie die resultierende Lösung, um alle Verunreinigungen zu entfernen, und verdampfen Sie sie.
Setzen Sie das Magnesium mit Schwefelsäure um und erhitzen Sie die Mischung, bis die Reaktion abgeschlossen ist. Filtern und verdampfen Sie dann die resultierende Lösung, um die Magnesium-MgSO4-Kristalle zu erhalten.
Sie können Magnesium MgSO4 auch durch Reaktion von Magnesiumchlorid mit Natrium MgSO4 erhalten. Der Prozess umfasst die Zugabe von Magnesiumchlorid zu einer Natrium-MgSO4-Lösung, das Rühren der resultierenden Mischung und das Erhitzen, bis sich Magnesium-MgSO4-Kristalle bilden.
Verwendung von Magnesiumsulfat
Magnesiumsulfat (MgSO4) hat viele Anwendungen in verschiedenen Bereichen. Zu seinen Verwendungsmöglichkeiten gehören:
- Medizinische Anwendungen: Zur Behandlung von Eklampsie und Präeklampsie während der Schwangerschaft sowie zur Vorbeugung von Anfällen bei Patienten mit schwerem Asthma oder Hypomagnesiämie. Es wirkt abführend und abführend.
- Landwirtschaft: Wird aufgrund seines hohen Magnesium- und Schwefelgehalts als Düngemittel verwendet. Landwirte nutzen es, um Magnesiummangel im Boden zu beheben.
- Lebensmittel- und Getränkeindustrie: Wird als Brausalz bei der Bierherstellung verwendet, um die Wasserchemie anzupassen und den Geschmack zu verbessern. Die Lebensmittelindustrie verwendet es als Gerinnungsmittel bei der Herstellung von Tofu.
- Industrielle Anwendungen: Wird als Trocknungsmittel und Trockenmittel sowie als Flammschutzmittel verwendet. Verschiedene Branchen nutzen es bei der Herstellung von Textilien, Papier und Chemikalien.
- Körperpflege: Menschen verwenden Magnesiumsulfat in Badesalzen und Fußbädern wegen seiner angeblichen gesundheitlichen Vorteile, einschließlich der Verringerung von Muskelschmerzen und Steifheit.
- Weitere Verwendungszwecke: Verwendung bei der Herstellung von Pigmenten, Sprengstoffen und bei der Reinigung von Metallen.
Fragen:
F: Welche Basis wird in Zahnpasta verwendet?
A: Die am häufigsten verwendete Basis in Zahnpasta ist normalerweise Calciumcarbonat oder Natriumbicarbonat. Diese Basen helfen beim Reinigen der Zähne und beim Entfernen von Plaque.
F: Wofür wird Magnesiumsulfat verwendet?
A: Magnesiumsulfat hat vielfältige Einsatzmöglichkeiten, unter anderem zur Behandlung von Eklampsie und Präeklampsie während der Schwangerschaft, als Abführ- und Abführmittel, als Düngemittel, als Brausalz, als Flammschutzmittel und als Trocknungsmittel. Es wird auch bei der Herstellung von Textilien, Papier und Chemikalien verwendet.
F: Ist Magnesiumsulfat löslich?
A: Magnesiumsulfat ist in Wasser und Alkohol löslich.
F: Ist Magnesiumsulfat wasserlöslich?
A: Ja, Magnesiumsulfat ist in Wasser gut löslich, mit einer Löslichkeit von etwa 25,5 g/100 ml bei Raumtemperatur.
F: Wofür wird Magnesiumsulfat verwendet?
A: Magnesiumsulfat hat je nach spezifischer Anwendung verschiedene Einsatzmöglichkeiten und Vorteile. Einige seiner Verwendungszwecke umfassen die medizinische Behandlung, als Düngemittel, als Brausalz, als feuerhemmendes Mittel und als Trocknungsmittel. Medizinisch kann Magnesiumsulfat zur Vorbeugung von Anfällen, zur Behandlung von Verstopfung sowie zur Linderung von Muskelschmerzen und -steifheit eingesetzt werden.
