Magnesiumphosphat (Mg3(PO4)2) ist eine Verbindung aus Magnesium- und Phosphationen. Es spielt eine entscheidende Rolle bei vielen biologischen Prozessen wie der DNA-Synthese, der Nervenfunktion und der Muskelkontraktion.
| IUPAC-Name | Magnesiumphosphat |
| Molekularformel | Mg3(PO4)2 |
| CAS-Nummer | 7757-87-1 |
| Synonyme | Trimagnesiumphosphat, Trimagnesiumorthophosphat, Magnesiumorthophosphat, tertiäres Magnesiumphosphat, tribasisches Magnesiumphosphat |
| InChI | InChI=1S/2Mg.3H3O4P/c;;3 1-5(2,3)4/h;;3 (H3,1,2,3,4)/q2*+2;;;/p-6 |
Eigenschaften von Magnesiumphosphat
Magnesiumphosphat-Formel
Die chemische Formel für Magnesiumphosphat lautet Mg3(PO4)2, was darauf hinweist, dass es drei Mg+2-Ionen und zwei PO43–Ionen enthält. Die Formel ist für stöchiometrische Berechnungen von entscheidender Bedeutung und hilft bei der Bestimmung der richtigen Menge an Reaktanten und Produkten bei chemischen Reaktionen mit Mg3(PO4)2.
Molmasse von Magnesiumphosphat
Mg3(PO4)2 hat eine Molmasse von 262,86 g/mol. Dieser Wert stellt die Masse eines Mols der Verbindung Mg3(PO4)2 dar, die eine Kombination aus drei Mg+2-Ionen und zwei PO4–Ionen ist. Die Molmasse ist eine entscheidende Eigenschaft, die in stöchiometrischen Berechnungen verwendet wird, um die Menge an Mg3(PO4)2 zu bestimmen, die in verschiedenen chemischen Reaktionen benötigt wird.
Siedepunkt von Magnesiumphosphat
Mg3(PO4)2 hat keinen definierten Siedepunkt, da es sich vor Erreichen seines Siedepunkts zersetzt. Bei hohen Temperaturen zerfällt Mg3(PO4)2 in Magnesiumoxid und Phosphorpentoxid, die Siedepunkte von 3.600 °C bzw. 300 °C haben. Die Zersetzungstemperatur von Mg3(PO4)2 hängt von verschiedenen Faktoren wie Konzentration, Heizrate und Druck ab.
Schmelzpunkt von Magnesiumphosphat
Mg3(PO4)2 hat einen Schmelzpunkt von 1188°C. Bei dieser Temperatur vollzieht die Verbindung einen Phasenwechsel vom festen in den flüssigen Zustand. Der Schmelzpunkt von Mg3(PO4)2 wird von verschiedenen Faktoren beeinflusst, darunter Druck, Verunreinigungen und Kristallstruktur.
Dichte von Magnesiumphosphat g/ml
Die Dichte von Mg3(PO4)2 variiert je nach Kristallstruktur und den Bedingungen, unter denen sie gemessen wird. Die häufigste Form von Mg3(PO4)2, Tri-Mg3(PO4)2, hat eine Dichte von 2,195 g/ml. Der Dichtewert ist entscheidend für die Bestimmung der Masse an Mg3(PO4)2, die erforderlich ist, um in verschiedenen Anwendungen ein bestimmtes Volumen zu erreichen.
Molekulargewicht von Magnesiumphosphat
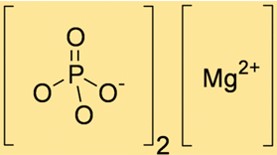
Mg3(PO4)2 hat ein Molekulargewicht von 262,86 g/mol. Dieser Wert wird durch Addition der Atomgewichte der in der Verbindung vorhandenen Mg- und PO43-Ionen berechnet. Das Molekulargewicht von Mg3(PO4)2 ist hilfreich bei der Bestimmung der Menge an Mg3(PO4)2, die in verschiedenen chemischen Reaktionen benötigt wird.
Struktur von Magnesiumphosphat
Mg3(PO4)2 hat eine Kristallstruktur, die je nach Herstellungsmethode und -bedingungen variiert. Die häufigste Form ist Tri-Mg3(PO4)2, dessen Kristallstruktur aus Mg+2-Ionen und PO43–Ionen besteht, die in einem hexagonalen Gitter angeordnet sind. Die Kristallstruktur beeinflusst die physikalischen und chemischen Eigenschaften von Mg3(PO4)2.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 2.195 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 262,86 g/Mol |
| Dichte | 2.195 g/ml |
| Fusionspunkt | 1188°C |
| Siedepunkt | Zersetzt sich vor dem Siedepunkt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Löslich in Säuren |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 7.2 |
| pH-Wert | 8-9 (10 %ige Lösung) |
Sicherheit und Gefahren von Magnesiumphosphat
Mg3(PO4)2 gilt allgemein als sicher und ungiftig. Es wird nicht als Gefahrstoff eingestuft und stellt kein erhebliches Risiko für die menschliche Gesundheit oder die Umwelt dar. Allerdings kann eine längere Exposition gegenüber hohen Konzentrationen von Mg3(PO4)2-Staub zu Reizungen der Atemwege führen. Die Einnahme großer Mengen Mg3(PO4)2 kann zu Magen-Darm-Reizungen und Übelkeit führen. Es ist wichtig, mit Mg3(PO4)2 vorsichtig umzugehen und beim Umgang mit großen Mengen der Verbindung geeignete persönliche Schutzausrüstung zu tragen. Verschüttete Flüssigkeiten oder Undichtigkeiten sollten umgehend beseitigt werden, um jegliche Rutsch- oder Sturzgefahr zu vermeiden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Nicht als gefährlich eingestuft |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2835.29.10 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | In normalen Konzentrationen ungiftig |
Methoden zur Magnesiumphosphat-Synthese
Zur Synthese von Mg3(PO4)2 gibt es mehrere Methoden, darunter Fällung, Reaktion von Magnesiumoxid mit Phosphorsäure und Reaktion von Magnesiumhydroxid mit Phosphorsäure.
Der Fällungsprozess beinhaltet die Zugabe eines löslichen Phosphatsalzes wie Na3PO4 zu einer Lösung, die ein lösliches Mg+2-Salz wie MgCl2 oder Magnesiumsulfat enthält. Durch das Mischen der beiden Lösungen entsteht dann ein Niederschlag von Mg3(PO4)2, der gesammelt und getrocknet werden kann.
Die Reaktion umfasst die Zugabe von Magnesiumoxid zu einer Phosphorsäurelösung und das Erhitzen der Mischung, um die Reaktion abzuschließen. Anschließend wird das entstehende Mg3(PO4)2 gesammelt und gewaschen, um etwaige Verunreinigungen zu entfernen.
Die Reaktion umfasst die Zugabe von Magnesiumhydroxid zu einer Phosphorsäurelösung und das Erhitzen der Mischung, um sie zu vervollständigen. Sammeln Sie dann das entstandene Mg3(PO4)2 und waschen Sie es gründlich, um alle Verunreinigungen zu entfernen.
Abhängig von der Qualität der Rohstoffe und den Reaktionsbedingungen kann mit diesen Methoden Mg3(PO4)2 mit unterschiedlichem Reinheitsgrad hergestellt werden.
Verwendung von Magnesiumphosphat
Mg3(PO4)2 wird in verschiedenen Branchen vielfältig eingesetzt, darunter:
- Lebensmittelindustrie: Wird als Lebensmittelzusatzstoff zur Regulierung des Säuregehalts und zur Verbesserung der Textur und Qualität von Backwaren, Milchprodukten und Getränken verwendet.
- Landwirtschaft: Wird als Dünger verwendet, um Pflanzen mit essentiellen Nährstoffen wie Magnesium und Phosphor zu versorgen.
- Pharmazeutische Industrie: Wird als Wirkstoff in Antazida und Abführmitteln verwendet, um die Symptome von Verdauungsstörungen und Verstopfung zu lindern.
- Wasseraufbereitung: Wird als Wasseraufbereitungschemikalie verwendet, um die Bildung von Ablagerungen in Kesseln und Rohren zu kontrollieren und Korrosion zu verhindern.
- Keramikindustrie: Wird als keramisches Bindemittel zur Verbesserung der Festigkeit und Haltbarkeit von Keramikprodukten verwendet.
- Feuerhemmend: Wird als Flammschutzmittel in Baumaterialien wie Isolierungen, Trockenbauwänden und Verkleidungen verwendet.
- Kosmetika: Wird in Kosmetika und Körperpflegeprodukten als Verdickungsmittel und Emulgator verwendet.
Fragen:
F: Wie lautet die richtige Formel für die Verbindung zwischen Mg+2- und PO43–Ionen?
A: Die korrekte Formel für die zwischen Mg+2-Ionen und PO43–Ionen gebildete Verbindung lautet Mg3(PO4)2.
F: Wie lautet die Formel für Magnesiumphosphat?
A: Die Formel für Magnesiumphosphat lautet Mg3(PO4)2.
F: Aus wie vielen Ionen besteht eine Formeleinheit Magnesiumphosphat?
A: Eine Formeleinheit von Mg3(PO4)2 enthält 11 Ionen: drei Mg+2-Ionen und zwei PO43–Ionen.
F: Ist Magnesiumphosphat löslich?
A: Mg3(PO4)2 hat eine geringe Löslichkeit in Wasser, mit einer Löslichkeit von etwa 0,1 g/100 ml bei Raumtemperatur.
F: Eine Säure (x) reagiert mit einer Base (y) unter Bildung von Mg3(PO4)2. Was sind x und y?
A: Die Säure (x) ist Phosphorsäure (H3PO4) und die Base (y) ist Magnesiumhydroxid (Mg(OH)2).
F: Wie groß ist die Molmasse von Mg3(PO4)2, einer Substanz, die früher medizinisch als Antazidum verwendet wurde?
A: Die Molmasse von Mg3(PO4)2 beträgt 262,86 g/mol.
F: Ist Mg3(PO4)2 wasserlöslich?
A: Mg3(PO4)2 hat eine geringe Löslichkeit in Wasser, mit einer Löslichkeit von etwa 0,1 g/100 ml bei Raumtemperatur.
F: Wie viele Mol Sauerstoffatome enthält ein Mol Mg3(PO4)2?
A: Ein Mol Mg3(PO4)2 enthält 8 Mol Sauerstoffatome.
