Magnesiumperoxid (MgO2) ist eine Verbindung aus Magnesium und Sauerstoff. Es wird in der Landwirtschaft häufig als Quelle für langsam freisetzenden Sauerstoff und als Bodenverbesserungsmittel zur Verbesserung des Pflanzenwachstums verwendet.
| IUPAC-Name | Magnesiumperoxid |
| Molekularformel | MgO2 |
| CAS-Nummer | 14452-57-4 |
| Synonyme | Magnesiumdioxid, Magnesium; Peroxid, Permag, Magics, Oxy-Gen, EINECS 215-217-9 |
| InChI | InChI=1S/Mg.2O2/h;2*1H/q+2;;/p-2 |
Eigenschaften von Magnesiumperoxid
Magnesiumperoxid-Formel
Die chemische Formel für Magnesiumperoxid lautet MgO2. Das bedeutet, dass ein Molekül Magnesiumperoxid ein Atom Magnesium und zwei Atome Sauerstoff enthält. Die Formel ist wichtig, da sie die Art und Anzahl der in der Verbindung vorhandenen Atome identifiziert und dabei hilft, die Stöchiometrie chemischer Reaktionen mit Magnesiumperoxid zu bestimmen.
Molmasse von Magnesiumperoxid
MgO2 hat eine Molmasse von 56.304 g/mol. Das bedeutet, dass ein Mol MgO2 56.304 Gramm der Verbindung enthält. Die Molmasse ist eine wichtige Eigenschaft von MgO2, da sie dabei hilft, zu bestimmen, wie viel der Substanz für chemische Reaktionen benötigt wird.
Siedepunkt von Magnesiumperoxid
MgO2 hat keinen festgelegten Siedepunkt, da es sich zersetzt, bevor es sieden kann. Beim Erhitzen zerfällt es in Magnesiumoxid und Sauerstoffgas. Diese Eigenschaft von MgO2 macht es als Sauerstoffquelle in verschiedenen Anwendungen nützlich.
Schmelzpunkt von Magnesiumperoxid
MgO2 hat einen Schmelzpunkt von 223 °C. Das bedeutet, dass bei Temperaturen über 700 °C die feste Verbindung flüssig wird. Der Schmelzpunkt ist eine wichtige Eigenschaft von MgO2, da er bestimmt, wie sich die Verbindung verhält, wenn sie hohen Temperaturen ausgesetzt wird.
Dichte von Magnesiumperoxid g/ml
Die Dichte von MgO2 beträgt 2,41 g/ml. Das bedeutet, dass ein Milliliter MgO2 2,41 Gramm wiegt. Die Dichte ist eine wichtige Eigenschaft von MgO2, da sie dabei hilft, die Masse eines bestimmten Volumens der Verbindung zu bestimmen.
Molekulargewicht von Magnesiumperoxid
Das Molekulargewicht von MgO2 beträgt 56,304 g/mol. Das bedeutet, dass ein Molekül MgO2 eine Masse von 56.304 atomaren Masseneinheiten hat. Das Molekulargewicht ist eine wichtige Eigenschaft von MgO2, da es dabei hilft, zu bestimmen, wie viel der Substanz für chemische Reaktionen benötigt wird.
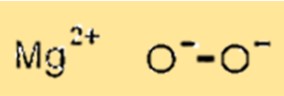
Struktur von Magnesiumperoxid
MgO2 hat eine Kristallstruktur mit Magnesiumionen, die die oktaedrischen Plätze der Gitterstruktur besetzen, und Sauerstoffionen, die die tetraedrischen Plätze besetzen. Diese Kristallstruktur ist wichtig, da sie die physikalischen und chemischen Eigenschaften von MgO2 bestimmt.
| Eigentum | Wert |
| Aussehen | weißes Puder |
| Spezifisches Gewicht | 3,15 g/cm³ |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 56,304 g/Mol |
| Dichte | 2,41 g/ml |
| Fusionspunkt | 223°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Löslich in Säuren |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Magnesiumperoxid
MgO2 gilt im Allgemeinen als sicher, wenn es richtig gehandhabt und verwendet wird. Es kann jedoch zu Reizungen der Haut, der Augen und der Atemwege führen. Das Verschlucken großer Mengen kann zu Magen-Darm-Reizungen, Erbrechen und Durchfall führen. Es ist wichtig, das Einatmen des Pulvers zu vermeiden und beim Umgang damit Schutzkleidung und -ausrüstung zu tragen. MgO2 ist weder brennbar noch explosiv, kann jedoch mit bestimmten Chemikalien wie Säuren und starken Oxidationsmitteln reagieren. Um versehentliche Reaktionen zu vermeiden, sind eine ordnungsgemäße Lagerung und Handhabung erforderlich. Bei Exposition oder Verschlucken sofort einen Arzt aufsuchen.
| Gefahrensymbole | Oh, Xi |
| Sicherheitsbeschreibung | Magnesiumperoxid kann beim Einatmen Haut- und Augenreizungen sowie Reizungen der Atemwege verursachen. Bei Verschlucken oder Hautkontakt kann es gesundheitsschädlich sein und schwere Augenschäden verursachen. Es besteht außerdem Brandgefahr, wenn es Hitze, Flammen oder Oxidationsmitteln ausgesetzt wird. |
| UN-Identifikationsnummern | UN1479 |
| HS-Code | 282910 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Magnesiumperoxid kann beim Einatmen Haut- und Augenreizungen sowie Reizungen der Atemwege verursachen. Bei Verschlucken oder Hautkontakt kann es gesundheitsschädlich sein und schwere Augenschäden verursachen. Es besteht außerdem Brandgefahr, wenn es Hitze, Flammen oder Oxidationsmitteln ausgesetzt wird. |
Synthesemethoden für Magnesiumperoxid
Es gibt verschiedene Methoden zur Synthese von MgO2, von denen jede ihre Vor- und Nachteile hat.
Eine Methode beinhaltet die Reaktion zwischen MgO und Wasserstoffperoxid . Bei dieser Methode mischt man MgO mit einer kleinen Menge Wasser zu einer Paste und gibt dann unter Rühren Wasserstoffperoxid hinzu. Das resultierende Produkt ist MgO2 und Wasser.
Eine andere Methode beinhaltet die Reaktion zwischen Mg(OH)2 und Wasserstoffperoxid . Der Chemiker löst Mg(OH)2 in Wasser auf, um eine Lösung zu bilden, dann rührt er die Mischung, während er langsam Wasserstoffperoxid hinzufügt. Das resultierende Produkt ist MgO2 und Wasser.
Eine dritte Methode beinhaltet die direkte Reaktion zwischen metallischem Magnesium und Sauerstoffgas bei hohen Temperaturen. Diese Methode erfordert spezielle Ausrüstung und wird nicht so häufig verwendet wie andere Methoden.
Verwendung von Magnesiumperoxid
MgO2 wird in verschiedenen Branchen vielfältig eingesetzt, darunter:
- Umweltanwendungen – Wird als sauerstofffreisetzende Verbindung bei der Boden- und Grundwassersanierung zum Abbau von Schadstoffen verwendet.
- Landwirtschaft – Wird aufgrund seiner langsam freisetzenden Sauerstoffeigenschaften, die das Pflanzenwachstum fördern, als Dünger und Bodenverbesserer verwendet.
- Medizinisch – Wird in einigen Zahnpastaformulierungen als Aufheller und Sauerstoffanreicherer für die Mundgesundheit verwendet.
- Chemische Herstellung – Wird bei der Herstellung von Spezialchemikalien wie Epoxiden, Persäuren und Perestern verwendet.
- Lebensmittelverarbeitung – Wird als Bleichmittel in Mehl und anderen Lebensmitteln verwendet.
- Textilindustrie – Wird als Bleichmittel in der Textilproduktion verwendet.
- Wasseraufbereitung – Wird zur Reinigung von Wasser durch Freisetzung von Sauerstoff und Abbau organischer Verbindungen verwendet.
Fragen:
F: Wofür wird Magnesiumperoxid verwendet?
A: MgO2 wird in verschiedenen Branchen eingesetzt, beispielsweise in der Umwelt, in der Landwirtschaft, im medizinischen Sektor, in der chemischen Fertigung, in der Lebensmittelverarbeitung, in der Textilindustrie und in der Wasseraufbereitung.
F: Welche Produkte entstehen, wenn man Wasserstoffperoxid und Magnesiumsulfat mischt?
A: Wenn H2O2 und Magnesiumsulfat gemischt werden, entstehen als Produkte MgO2, Wasser und Sauerstoffgas.
F: Wird Magnesiumperoxid in Laboren verwendet?
A: Ja, MgO2 wird in Laboratorien für verschiedene Zwecke wie chemische Reaktionen, Wasseraufbereitung und Umwelthygiene verwendet.
F: Zersetzt Magnesium Wasserstoffperoxid?
A: Magnesium baut H2O2 nicht selbstständig ab. Magnesium kann jedoch in Gegenwart eines Katalysators wie Kaliumiodid mit H2O2 reagieren und Sauerstoffgas freisetzen.
F: Welche der folgenden Einheiten ist nicht die richtige Formeleinheit? k2o mgo2 al2o3 sro
A: Mgo2 ist keine korrekte Formeleinheit. Die korrekte Formeleinheit für Magnesiumoxid ist MgO.
F: Was sind die Produkte dieser kombinierten Reaktion? MGO + CO2 MGO3 + C MGO3 MGO2 MGO + O2 CO2 + O2
A: Das bei der kombinierten Reaktion von MGO und CO2 gebildete Produkt ist MgCO3.
F: Flüssiges, gasförmiges oder festes Mgo2?
A: Mgo2 ist eine feste Verbindung.
