Magnesiumiodid ist eine chemische Verbindung mit der Formel MgI2. Es ist ein weißer kristalliner Feststoff, der in Wasser und Alkohol gut löslich ist. MgI2 wird häufig als Jodquelle in organischen Synthesereaktionen verwendet.
| Name der IUPAC | Magnesiumjodid |
| Molekularformel | MgI2 |
| CAS-Nummer | 10377-58-9 |
| Synonyme | Magnesiumdiiodid, Magnesium(II)-iodid, UNII-14R347R70C |
| InChI | InChI=1S/2HI.Mg/h2*1H;/q;;+2/p-2 |
Eigenschaften von Magnesiumjodid
Magnesiumjodid-Formel
Die chemische Formel für Magnesiumiodid lautet MgI2. Diese Formel besagt, dass ein Magnesiumiodidmolekül aus einem Mg2+-Kation und zwei I–Anionen besteht. Die Formel für Magnesiumiodid ist hilfreich bei der Bestimmung der Stöchiometrie chemischer Reaktionen und der Vorhersage der Produkte chemischer Reaktionen, an denen die Verbindung beteiligt ist.
Molmasse von Magnesiumiodid
MgI2 hat eine Molmasse von 278.113 g/mol. Dieser Wert ergibt sich aus der Addition der Atommasse eines Mg-Atoms (24,305 g/mol) zur Atommasse von zwei I-Atomen (253,808 g/mol), die in einem MgI2-Molekül vorhanden sind. Die Molmasse von MgI2 ist ein wichtiger Parameter zur Bestimmung der Masse einer bestimmten Menge der Verbindung, der in vielen industriellen und wissenschaftlichen Anwendungen nützlich ist.
Siedepunkt von Magnesiumiodid
MgI2 hat einen relativ hohen Siedepunkt von 1309 °C. Dies weist darauf hin, dass eine beträchtliche Energiemenge erforderlich ist, um die intermolekularen Anziehungskräfte zwischen den Mg- und I-Atomen in der Verbindung aufzubrechen. Der Siedepunkt von MgI2 macht es für Hochtemperaturanwendungen geeignet, beispielsweise bei der Herstellung von Halbleitern und anderen elektronischen Bauteilen.
Schmelzpunkt von Magnesiumiodid
Der Schmelzpunkt von MgI2 beträgt 637°C. Bei dieser Temperatur geht das feste MgI2 in den flüssigen Zustand über. Der Schmelzpunkt von MgI2 ist eine wichtige physikalische Eigenschaft, die seine Eignung für verschiedene Anwendungen bestimmt. Aufgrund des hohen Schmelzpunkts eignet sich MgI2 beispielsweise ideal für den Einsatz als Flussmittel bei der Herstellung von Aluminiumlegierungen, bei denen es notwendig ist, Metalle zusammenzuschmelzen, um eine homogene Mischung zu erzeugen.
Dichte von Magnesiumiodid g/ml
Die Dichte von MgI2 beträgt 4,43 g/ml. Dieser Wert gibt die Masse der Verbindung an, die in einem bestimmten Raumvolumen vorhanden ist. Die Dichte von MgI2 ist ein wichtiger Faktor, der bei der Bestimmung der für eine bestimmte Anwendung erforderlichen Verbindungsmenge berücksichtigt werden muss. Die hohe Dichte von MgI2 macht es auch als Abschirmmaterial in Kernreaktoren nützlich.
Molekulargewicht von Magnesiumiodid
Das Molekulargewicht von MgI2 beträgt 278,113 g/mol. Dieser Wert ist die Summe der Atomgewichte der Bestandteile der Verbindung, Mg und I. Das Molekulargewicht von MgI2 ist nützlich zur Berechnung der Stöchiometrie chemischer Reaktionen und zur Bestimmung der Anzahl der Mol der Verbindung, die in einer bestimmten Probe vorhanden ist.
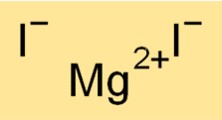
Struktur von Magnesiumiodid
MgI2 hat eine Kristallstruktur, die zum hexagonalen Kristallsystem gehört. Die Struktur besteht aus Magnesiumkationen und Iodidanionen, die in einem hexagonalen Gitter angeordnet sind. Mg2+-Kationen besetzen die Mitte der sechseckigen Zellen, während I–Anionen die Ecken der Zellen besetzen. Die Kristallstruktur von MgI2 trägt zu seinen physikalischen und chemischen Eigenschaften bei, wie zum Beispiel seinen hohen Schmelz- und Siedepunkten.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 4,43 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 278.113 g/Mol |
| Dichte | 4,43 g/ml |
| Fusionspunkt | 637°C |
| Siedepunkt | 1.309°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Alkohol, Aceton |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Magnesiumiodid
MgI2 gilt im Allgemeinen als sicher, wenn es richtig gehandhabt und verwendet wird. Allerdings kann es, wie jede chemische Verbindung, gewisse Gefahren bergen, wenn es nicht sorgfältig gehandhabt wird. MgI2 wird als haut- und augenreizend eingestuft und eine längere Exposition gegenüber der Verbindung kann zu einer Hautsensibilisierung oder Reizung der Atemwege führen. Beim Umgang mit MgI2 ist es wichtig, geeignete persönliche Schutzausrüstung zu tragen, einschließlich Handschuhen, Augenschutz und gegebenenfalls einer Atemschutzmaske. Darüber hinaus kann MgI2 heftig mit Wasser reagieren und brennbares Wasserstoffgas freisetzen. Daher muss es fern von Feuchtigkeitsquellen gelagert und gehandhabt werden.
| Gefahrensymbole | Xi: Irritierend |
| Sicherheitsbeschreibung | S22: Staub nicht einatmen. S24: Berührung mit der Haut vermeiden. S36/37/39: Geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen. |
| UN-Identifikationsnummern | UN3077 |
| HS-Code | 28276000 |
| Gefahrenklasse | 9: Verschiedene gefährliche Güter |
| Verpackungsgruppe | III |
| Toxizität | Geringe Toxizität |
Methoden zur Magnesiumiodid-Synthese
Es gibt mehrere Methoden zur Synthese von MgI2, von denen jede ihre Vorteile und Einschränkungen hat.
Eine übliche Methode beinhaltet die Reaktion von Magnesiummetall mit Jod in einem wasserfreien Ether- oder Tetrahydrofuran (THF)-Lösungsmittel. Bei dieser Reaktion entsteht MgI2 in Form eines weißen festen Niederschlags.
Eine andere Methode beinhaltet die Reaktion von Magnesiumoxid oder Magnesiumhydroxid mit Jodwasserstoffsäure. Bei dieser Methode wird im Allgemeinen Magnesiumoxid oder -hydroxid mit Jodwasserstoffsäure erhitzt, um MgI2 herzustellen.
Bei der Reaktion von Magnesiumcarbonat oder Magnesiumoxid mit Jodwasserstoffgas entsteht ebenfalls MgI2. Diese Reaktion findet im Allgemeinen bei hohen Temperaturen statt und erzeugt MgI2 als weißes Feststoffprodukt.
Insgesamt hängt die Wahl der MgI2-Synthesemethode von Faktoren wie der gewünschten Reinheit des Endprodukts, der Verfügbarkeit von Rohstoffen und den Bedingungen ab, unter denen die Synthese durchgeführt wird.
Verwendung von Magnesiumjodid
Aufgrund seiner einzigartigen Eigenschaften findet MgI2 viele Einsatzmöglichkeiten in verschiedenen Bereichen. Hier sind einige häufige Anwendungen von MgI2:
- Als Katalysator: Wird als Katalysator bei organischen chemischen Reaktionen verwendet, insbesondere bei der Bildung von Kohlenstoff-Kohlenstoff-Bindungen.
- Bei der Herstellung von Grignard-Reagenzien: Wird bei der Herstellung von Grignard-Reagenzien verwendet. Organische Chemiker verwenden Grignard-Reagenzien, um eine breite Palette organischer Verbindungen zu synthetisieren.
- Medizinisch: Wird medizinisch als Ergänzung verwendet, um den Körper mit essentiellem Magnesium und Jod zu versorgen, die für die Aufrechterhaltung gesunder Körperfunktionen wichtig sind.
- In Kernreaktoren: Wird in Kernreaktoren als Neutronenabsorber zur Steuerung der Geschwindigkeit von Spaltungsreaktionen verwendet.
- Fotografische Entwicklung: Wird bei der fotografischen Entwicklung als Stabilisierungsmittel verwendet, um Oxidation und Zersetzung fotografischer Filme zu verhindern.
- Bei der Herstellung von Magnesiummetall: Wird auch als Vorläufer bei der Herstellung von Magnesiummetall verwendet, das in verschiedenen Industriezweigen vielfältige Anwendung findet.
Fragen:
F: Welche Art der Auflösung würde MgI2 durchlaufen?
A: MgI2 würde aufgrund seiner Natur als ionische Verbindung einer ionischen Auflösung unterliegen.
F: Wie lautet die chemische Formel von Magnesiumiodid?
A: Die chemische Formel für Magnesiumiodid lautet MgI2.
F: Ist MgI2 löslich?
A: Ja, MgI2 ist in Wasser, Alkohol und Ether löslich.
F: Wie lautet die Formel für Magnesiumiodid?
A: Die Formel für Magnesiumiodid lautet MgI2.
F: Welche Art von Verbindung ist MgI2?
A: MgI2 ist eine ionische Verbindung, die durch die Übertragung zweier Elektronen von Magnesium auf Jod entsteht.
F: Welche Verbindung hat die chemische Formel MgI2?
A: Die Verbindung mit der chemischen Formel MgI2 ist Magnesiumiodid.
F: Wie heißt die Verbindung mit der Formel MgI2?
A: Der Name der Verbindung mit der Formel MgI2 ist Magnesiumjodid.
