Magnesiumhypochlorit (Mg(ClO)2) ist eine chemische Verbindung aus Magnesium, Sauerstoff und Chlor. Es wird als Desinfektionsmittel, Bleichmittel und Wasseraufbereitungschemikalie verwendet.
| Name der IUPAC | Magnesiumhypochlorit |
| Molekularformel | Mg(ClO)2 |
| CAS-Nummer | 10233-03-1 |
| Synonyme | Magnesiumchlorat, Magnesiumsalz der unterchlorigen Säure, Magnesiumoxychlorid, MagOCl |
| InChI | InChI=1S/Cl2O2.Mg/c1-3-2;/q-1;+2 |
Eigenschaften von Magnesiumhypochlorit
Magnesiumhypochlorit-Formel
Magnesiumhypochlorit hat die chemische Formel Mg(ClO)2, was bedeutet, dass es ein Magnesiumatom, zwei Chloratome und zwei Sauerstoffatome pro Molekül enthält. Es ist ein weißer Feststoff mit leichtem Chlorgeruch und wird häufig als Desinfektionsmittel und Wasseraufbereitungschemikalie verwendet.
Molmasse von Magnesiumhypochlorit
Die Molmasse von Mg(ClO)2 beträgt 127,21 g/mol. Dieser Wert wird durch Addition der Atommassen jedes Elements in der chemischen Formel berechnet, nämlich Magnesium (24,31 g/mol), Chlor (35,45 g/mol) und Sauerstoff (15,99 g/mol). mol), multipliziert mit ihren jeweiligen Indizes.
Siedepunkt von Magnesiumhypochlorit
Mg(ClO)2 hat keinen definierten Siedepunkt, da es sich vor Erreichen seines Siedepunkts zersetzt. Beim Erhitzen setzt Mg(ClO)2 Sauerstoffgas frei und hinterlässt Magnesiumchlorid als festen Rückstand.
Schmelzpunkt von Magnesiumhypochlorit
Der Schmelzpunkt von Mg(ClO)2 beträgt 100°C. Bei dieser Temperatur verwandeln sich die festen Mg(ClO)2-Kristalle in eine Flüssigkeit. Aufgrund seiner Instabilität bei hohen Temperaturen wird jedoch ein vorsichtiger Umgang empfohlen.
Dichte von Magnesiumhypochlorit g/ml
Die Dichte von Mg(ClO)2 beträgt bei Raumtemperatur 2,08 g/ml. Das bedeutet, dass ein Milliliter Mg(ClO)2 eine Masse von 2,08 Gramm hat.
Molekulargewicht von Magnesiumhypochlorit
Das Molekulargewicht von Mg(ClO)2 beträgt 127,21 g/mol. Es ist die Summe der Atomgewichte aller Elemente in der Verbindung, nämlich Magnesium, Chlor und Sauerstoff.
Struktur von Magnesiumhypochlorit
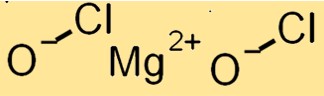
Mg(ClO)2 hat eine Kristallstruktur mit einem monoklinen Kristallsystem. Es besteht aus Mg+2-Kationen und ClO-Anionen, die durch ionische Bindungen zusammengehalten werden. Die ClO-Anionen liegen in einer verzerrten tetraedrischen Anordnung um die Mg+2-Kationen herum.
Löslichkeit von Magnesiumhypochlorit
Mg(ClO)2 ist in Wasser leicht löslich, mit einer Löslichkeit von 14,6 g/100 ml bei 20 °C. Aufgrund der Hydrolyse von Hypochloritionen bildet es in Wasser eine leicht basische Lösung. Es wird jedoch nicht empfohlen, Mg(ClO)2 in Wasser aufzulösen, da dadurch Chlorgas entstehen kann, das giftig ist und gesundheitsschädlich sein kann.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 2,08 g/ml bei 20 °C |
| Farbe | Weiß |
| Geruch | Leicht chloriert |
| Molmasse | 127,21 g/Mol |
| Dichte | 2,08 g/ml bei 20 °C |
| Fusionspunkt | 100°C |
| Siedepunkt | Zersetzt sich vor Erreichen des Siedepunkts |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich (14,6 g/100 ml bei 20 °C) |
| Löslichkeit | In Wasser schwer löslich, in Säuren löslich |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Etwas einfache Lösung |
Sicherheit und Gefahren von Magnesiumhypochlorit
Mg(ClO)2 kann bei unsachgemäßer Handhabung gefährlich sein. Es ist ein starkes Oxidationsmittel, das mit bestimmten Chemikalien heftig reagieren kann. Kontakt mit Haut, Augen und Schleimhäuten kann zu Reizungen und Verbrennungen führen. Das Einatmen von Staub oder Nebel kann zu Atemproblemen führen. Es ist außerdem wichtig, das Mischen von Mg(ClO)2 mit Säuren oder anderen chlorhaltigen Verbindungen zu vermeiden, da dadurch giftiges Chlorgas entstehen kann. Es wird empfohlen, beim Umgang mit Mg(ClO)2 Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen und es an einem kühlen, trockenen Ort, entfernt von unverträglichen Chemikalien, aufzubewahren.
| Gefahrensymbole | Oxidationsmittel, gesundheitsschädlich |
| Sicherheitsbeschreibung | Von Hitze, Funken und offenen Flammen fernhalten. Atmen Sie keinen Staub oder Nebel ein. Tragen Sie Handschuhe und Schutzbrille. |
| UN-Identifikationsnummern | Ein 1748 |
| HS-Code | 2828.10.10 |
| Gefahrenklasse | 5.1 (Oxidationsmittel), 6.1 (giftig) |
| Verpackungsgruppe | II |
| Toxizität | LD50 (oral, Ratte) – 290 mg/kg; LC50 (Inhalation, Ratte) – 2,07 mg/L/4h; Hautreizung – Leicht; Augenreizung – Schwerwiegend |
Methoden zur Magnesiumhypochlorit-Synthese
Die am häufigsten verwendete Methode zur Synthese von Mg(ClO)2 ist die Reaktion von Magnesiumoxid mit Chlorgas.
Bei einer Methode zur Herstellung von Mg(ClO)2 muss Magnesiumoxid in Gegenwart von Wasser mit Chlorgas gemischt werden. Während der exothermen Reaktion ist eine sorgfältige Kontrolle erforderlich, um die Bildung unerwünschter Nebenprodukte zu vermeiden.
Eine andere Methode beinhaltet die Reaktion zwischen Magnesiumhydroxid und hypochloriger Säure. Um den pH-Wert aufrechtzuerhalten, findet die Reaktion üblicherweise in einer Natriumhydroxidlösung statt. Die resultierende Mg(ClO)2-Lösung kann durch Filtration abgetrennt und nach der Reaktion getrocknet werden.
Eine dritte Methode beinhaltet die Reaktion zwischen Magnesiumcarbonat und hypochloriger Säure. Bei dieser Reaktion entstehen Mg(ClO)2 und Kohlendioxid. Um die Bildung unerwünschter Nebenprodukte zu vermeiden, ist eine sorgfältige Überwachung der Reaktion erforderlich.
Unabhängig von der verwendeten Synthesemethode ist es aufgrund seiner oxidierenden Eigenschaften und potenziellen Gefahren wichtig, mit Mg(ClO)2 vorsichtig umzugehen.
Verwendung von Magnesiumhypochlorit
Mg(ClO)2 hat aufgrund seiner oxidierenden Eigenschaften und seiner Fähigkeit, Chlorgas freizusetzen, mehrere praktische Anwendungen. Hier sind einige häufige Verwendungen von Mg(ClO)2:
- Wasseraufbereitung: Wird häufig als Desinfektionsmittel in Wasseraufbereitungsanlagen verwendet, um schädliche Bakterien und Viren abzutöten.
- Bleichmittel: Wird als Bleichmittel für Textilien, Papier und andere Materialien verwendet.
- Schwimmbäder: Wird als Desinfektionsmittel in Schwimmbädern verwendet, um eine gute Wasserchemie aufrechtzuerhalten.
- Geruchskontrolle: Wird zur Kontrolle unangenehmer Gerüche in Abfallbehandlungsanlagen und Abwassersystemen verwendet.
- Oxidationsmittel: Wird als Oxidationsmittel bei der Herstellung verschiedener Chemikalien wie Epoxide und Ketone verwendet.
- Landwirtschaft: Wird in der Landwirtschaft als Desinfektionsmittel und Pestizid zur Bekämpfung von Pilz- und Bakterienkrankheiten verwendet.
- Hygiene: Wird auch als Desinfektionsmittel für Oberflächen und Geräte in Krankenhäusern, Lebensmittelverarbeitungsbetrieben und anderen Einrichtungen verwendet.
Fragen:
F: Wie lautet die Formel für Magnesiumhypochlorit?
A: Die Formel für Magnesiumhypochlorit lautet Mg(ClO)2.
F: Wie hoch ist der pH-Wert von Magnesiumhypochlorit?
A: Der pH-Wert von Mg(ClO)2 hängt von seiner Konzentration ab und kann variieren. Allerdings hat eine Lösung von Mg(ClO)2 im Allgemeinen einen pH-Wert zwischen 8 und 10.
F: Wie lautet die Summenformel von Magnesiumhypochlorit?
A: Die Summenformel von Magnesiumhypochlorit lautet Mg(ClO)2.
F: Wie heißt Mg(ClO)2?
A: Der Name für Mg(ClO)2 ist Magnesiumhypochlorit.
F: Ist Mg(ClO)2 eine Säure oder eine Base?
A: Mg(ClO)2 ist ein basisches Salz und kann in wässrigen Lösungen als schwache Base wirken.
F: Ist Mg(ClO)2 ein Salz?
A: Ja, Mg(ClO)2 ist Salz. Es handelt sich um eine weiße kristalline Verbindung, die gut wasserlöslich ist und sowohl ein Metall (Magnesium) als auch ein Nichtmetall (Chlor) enthält.
