Magnesiumhydroxid (Mg(OH)2) ist ein Antazida und Abführmittel zur Behandlung von Sodbrennen, Verdauungsstörungen und Verstopfung. Es neutralisiert die Magensäure und zieht Wasser in den Dickdarm, um den Stuhlgang zu fördern.
| IUPAC-Name | Magnesiumhydroxid |
| Molekularformel | Mg(OH)2 |
| CAS-Nummer | 1309-42-8 |
| Synonyme | Magnesiamilch; Brucit; Magnesiumdihydroxid; Hydromagnesit; Weiße Magnesia |
| InChI | InChI=1S/2H2O.Mg/h2*1H2;/q;;+2/p-2 |
Eigenschaften von Magnesiumhydroxid
Magnesiumhydroxid-Formel
Die chemische Formel für Magnesiumhydroxid lautet Mg(OH)2. Diese Formel besagt, dass ein Magnesiumatom an zwei Hydroxidionen gebunden ist. Die Magnesiumhydroxidformel wird zur Berechnung der Molmasse, Dichte und anderer physikalischer Eigenschaften der Substanz verwendet. Die Formel gibt auch Aufschluss über die Struktur der Substanz, da sie die Anzahl und Art der in einem Magnesiumhydroxidmolekül vorhandenen Atome angibt.
Molmasse von Magnesiumhydroxid
Die Molmasse von Mg(OH)2 beträgt 58,32 g/mol. Dies ist die Masse eines Mols Mg(OH)2, das ein Mol Mg-Atome und zwei Mol OH-Ionen enthält. Die Molmasse ist ein wichtiges Konzept in der Chemie, da sie zur Berechnung der Stoffmenge in einer bestimmten Probe verwendet wird.
Siedepunkt von Magnesiumhydroxid
Mg(OH)2 hat keinen eindeutigen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Die Zersetzungstemperatur von Mg(OH)2 beträgt etwa 350°C. Beim Erhitzen zersetzt sich Mg(OH)2 unter Bildung von Magnesiumoxid und Wasser.
Schmelzpunkt von Magnesiumhydroxid
Der Schmelzpunkt von Mg(OH)2 beträgt 350°C. Bei dieser Temperatur geht das feste Mg(OH)2 in den flüssigen Zustand über. Dieser Vorgang wird als Zusammenführen bezeichnet. Der Schmelzpunkt ist eine wichtige physikalische Eigenschaft eines Stoffes, denn er bestimmt die Temperatur, bei der ein Feststoff flüssig wird.
Dichte von Magnesiumhydroxid g/ml
Die Dichte von Mg(OH)2 beträgt etwa 2,36 g/ml. Die Dichte ist definiert als die Masse eines Stoffes pro Volumeneinheit. Mg(OH)2 ist aufgrund seiner hohen Molmasse und der Anwesenheit von zwei OH-Ionen pro Mg-Atom eine relativ dichte Substanz.
Molekulargewicht von Magnesiumhydroxid
Das Molekulargewicht von Mg(OH)2 beträgt 58,32 g/mol. Es ist die Summe der Atomgewichte aller Atome in einem Mg(OH)2-Molekül. Das Molekulargewicht ist ein nützliches Konzept in der Chemie, da es zur Bestimmung der Menge einer Substanz in einer bestimmten Probe verwendet wird.
Struktur von Magnesiumhydroxid
Mg(OH)2 hat eine Schichtstruktur, die aus Mg2+-Ionen und OH–Ionen besteht. Die Mg2+-Ionen sind von sechs OH–Ionen umgeben und die OH–Ionen sind in einer dicht gepackten hexagonalen Struktur angeordnet. Aus der Schichtstruktur von Mg(OH)2 ergeben sich seine charakteristischen Eigenschaften, wie seine geringe Löslichkeit in Wasser und seine Fähigkeit, in Wasser eine Suspension zu bilden.
| Aussehen | Weißes Pulver oder Suspension |
| Spezifisches Gewicht | 2,36 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 58,32 g/Mol |
| Dichte | 2,36 g/ml |
| Fusionspunkt | 350°C |
| Siedepunkt | Zersetzt sich bei 350°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 12 mg/L bei 20°C |
| Löslichkeit | Unlöslich in Ethanol und Ether |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | 10.4 |
| pH-Wert | 10.5 |
Sicherheit und Gefahren von Magnesiumhydroxid
Mg(OH)2 gilt im Allgemeinen als sicher in der Handhabung und Verwendung, weist eine geringe Toxizität auf und weist keine bekannten krebserregenden Wirkungen auf. Allerdings kann eine längere Exposition gegenüber Mg(OH)2-Staub oder -Pulver zu Atemwegsreizungen und Lungenschäden führen. Mg(OH)2 kann bei Kontakt auch Reizungen oder Verätzungen an Augen, Haut und Schleimhäuten verursachen. Beim Umgang mit Mg(OH)2 ist es wichtig, entsprechende Sicherheitsvorkehrungen zu treffen, wie z. B. das Tragen von Schutzausrüstung und das Arbeiten in einem gut belüfteten Bereich. Bei Kontakt oder Exposition einen Arzt aufsuchen und die betroffenen Stellen gründlich mit Wasser abspülen.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | – Einatmen und Kontakt mit Augen, Haut und Kleidung vermeiden. – Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen. – In einem gut belüfteten Bereich verwenden. |
| UN-Identifikationsnummern | Nicht reguliert |
| HS-Code | 2826.90.90 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität; Eine längere Exposition kann zu Reizungen der Atemwege und Lungenschäden führen. |
Synthesemethoden für Magnesiumhydroxid
Zur Synthese von Mg(OH)2 gibt es verschiedene Methoden, etwa Fällung, hydrothermale Synthese und elektrochemische Abscheidung.
Bei der Fällungsmethode wird Natriumhydroxid oder Ammoniumhydroxid mit Magnesiumchlorid oder Magnesiumsulfat zu Mg(OH)2 umgesetzt. Bei der Reaktion entsteht Mg(OH)2, das dann jemand sammeln und trocknen kann.
Um eine hydrothermale Synthese durchzuführen, muss man Wasser auf hohen Druck und hohe Temperatur erhitzen und dabei entweder Magnesiumoxid oder Magnesiumcarbonat hinzufügen. Bei diesem Prozess entsteht Mg(OH)2 und Sie können die Kristalle sammeln, indem Sie die resultierende Lösung abkühlen.
Bei der elektrochemischen Abscheidung wird ein elektrischer Strom durch eine Lösung von Magnesiumionen geleitet, wodurch diese mit Hydroxidionen reagieren und an der Kathode Mg(OH)2 bilden.
Andere Methoden zur Synthese von Mg(OH)2 umfassen die Verwendung von Magnesiumoxid und Kalkmilch sowie die thermische Zersetzung von Magnesiumbicarbonat.
Jede Methode hat ihre Vor- und Nachteile hinsichtlich Wirksamkeit, Effizienz und Kosten. Die Wahl der Synthesemethode hängt von der konkreten Anwendung und den gewünschten Eigenschaften des Mg(OH)2-Produkts ab.
Verwendung von Magnesiumhydroxid
Mg(OH)2 hat ein breites Anwendungsspektrum in verschiedenen Branchen, darunter:
- Antazidum: Wird häufig als Antazidum verwendet, um die Magensäure zu neutralisieren und Sodbrennen, Verdauungsstörungen und andere Verdauungsbeschwerden zu lindern.
- Flammschutzmittel: Ein ungiftiges Flammschutzmittel, das in Kunststoffen, Gummi und Textilien verwendet wird, um die Brandgefahr zu verringern.
- pH-Einstellung: Wird verwendet, um den pH-Wert verschiedener Produkte anzupassen, einschließlich Wasseraufbereitungslösungen, Kosmetika und Pharmazeutika.
- Umweltsanierung: Wird bei der Abwasseraufbereitung und der Entwässerung saurer Minen verwendet, um saure Bedingungen zu neutralisieren und Schwermetalle zu entfernen.
- Dünger: Wird als Dünger verwendet, um Pflanzen mit Magnesium zu versorgen und den pH-Wert des Bodens zu verbessern.
- Medizinische Anwendungen: Wird als Abführmittel und bei einigen medizinischen Eingriffen wie Koloskopien zur Reinigung des Darms verwendet.
- Andere Anwendungen: Wird als Stabilisator in Latexfarben, als Weißmacher in Papier und als Poliermittel in Glas und Keramik verwendet.
Fragen:
F: Welche Basis wird in Zahnpasta verwendet?
A: Mg(OH)2 wird häufig als Basis in Zahnpasten verwendet, um saure Zustände im Mund zu neutralisieren und das Risiko von Karies zu verringern.
F: Wie lautet die Formel für Magnesiumhydroxid?
A: Die chemische Formel für Magnesiumhydroxid lautet Mg(OH)2.
F: Welche chemische Gleichung zeigt die Dissoziation von Magnesiumhydroxid?
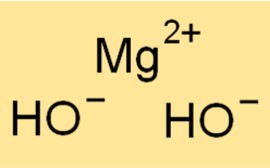
A: Die chemische Gleichung für die Dissoziation von Mg(OH)2 lautet
Mg(OH)2 → Mg2+ + 2OH-.
F: Ist Magnesiumhydroxid wasserlöslich?
A: Mg(OH)2 ist in Wasser schlecht löslich, d. h. es löst sich nur in sehr begrenztem Maße auf.
F: Welche der folgenden Substanzen ist eine Arrheniussäure? BF3, HCN, NH3, Mg(OH)2?
A: Bei keinem der aufgeführten Stoffe handelt es sich um Arrhenius-Säuren. BF3 und HCN sind Lewis-Säuren, NH3 ist eine schwache Arrhenius-Base und Mg(OH)2 ist eine starke Arrhenius-Base.
F: Ist Mg(OH)2 wasserlöslich?
A: Mg(OH)2 ist in Wasser schlecht löslich, d. h. es löst sich nur in sehr begrenztem Maße auf.
F: Wie groß ist die Molmasse von Mg(OH)2?
A: Die Molmasse von Mg(OH)2 beträgt etwa 58,32 g/mol.
F: Ist Mg(OH)2 eine Säure oder eine Base?
A: Mg(OH)2 ist eine Base, weil es Wasserstoffionen (Protonen) aufnehmen kann, um Wasser und ein Salz zu bilden.
