Magnesiumcarbonat (MgCO3) ist eine weiße, pulverförmige Substanz, die häufig als Antazidum und Abführmittel verwendet wird. Es ist auch in bestimmten Kosmetika und Zahnpasten enthalten. Magnesiumcarbonat hilft, überschüssige Magensäure zu neutralisieren und Verstopfung zu lindern.
| Name der IUPAC | Magnesiumcarbonat |
| Molekularformel | MgCO3 |
| CAS-Nummer | 546-93-0 |
| Synonyme | Magnesit, Magnesia carbonica, Magnesiumsalz, (MgCO3) |
| InChI | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Eigenschaften von Magnesiumcarbonat
Magnesiumcarbonat-Formel
Die chemische Formel für Magnesiumcarbonat lautet MgCO3. Diese Formel gibt an, dass Magnesiumcarbonat ein Mg+2-Ion und ein CO3 2–Ion enthält. Das CO3 2-Ion besteht aus einem C-Atom und drei O-Atomen. Die chemische Formel von Magnesiumcarbonat ist eine wichtige Eigenschaft, da sie die Zusammensetzung von Magnesiumcarbonat und seinen Bestandteilen angibt.
Molmasse von Magnesiumcarbonat
Die Molmasse von MgCO3 beträgt 84,31 g/mol. Dieser Wert ergibt sich aus der Addition der Atommassen der Magnesium-, Kohlenstoff- und Sauerstoffatome in einem Mol MgCO3. Die Molmasse ist eine wichtige physikalische Eigenschaft von MgCO3, da sie in verschiedenen Berechnungen verwendet wird, beispielsweise zur Bestimmung der Anzahl der Mol MgCO3 in einer bestimmten Probe.
Siedepunkt von Magnesiumcarbonat
MgCO3 hat keinen definierten Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zersetzt sich MgCO3 zu Magnesiumoxid und Kohlendioxid. Die Zersetzung von MgCO3 erfolgt bei einer Temperatur von etwa 350 °C.
Schmelzpunkt von Magnesiumcarbonat
Der Schmelzpunkt von MgCO3 liegt bei 990°C. Bei dieser Temperatur schmilzt MgCO3 und zersetzt sich unter Bildung von Magnesiumoxid und Kohlendioxid. Der Schmelzpunkt von MgCO3 ist eine wichtige physikalische Eigenschaft, da er die Temperatur bestimmt, bei der MgCO3 geschmolzen und verarbeitet werden kann.
Dichte von Magnesiumcarbonat g/ml
Die Dichte von MgCO3 beträgt 2,958 g/ml. Dieser Wert wird ermittelt, indem man die Masse eines Mols MgCO3 durch sein Volumen dividiert. Die Dichte von MgCO3 ist eine wichtige physikalische Eigenschaft, da sie in verschiedenen Anwendungen verwendet wird, beispielsweise zur Bestimmung des Auftriebs von MgCO3 in einer bestimmten Lösung.
Molekulargewicht von Magnesiumcarbonat
Das Molekulargewicht von MgCO3 beträgt 84,31 g/mol. Dieser Wert ergibt sich aus der Addition der Atommassen der Magnesium-, Kohlenstoff- und Sauerstoffatome in einem MgCO3-Molekül. Das Molekulargewicht von MgCO3 ist eine wichtige physikalische Eigenschaft, da es in verschiedenen Berechnungen verwendet wird, beispielsweise zur Bestimmung der Menge an MgCO3, die für eine bestimmte chemische Reaktion erforderlich ist.
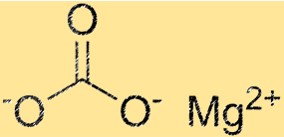
Struktur von Magnesiumcarbonat
MgCO3 hat eine trigonale Kristallstruktur. Das Magnesiumion befindet sich im Zentrum der Struktur und ist von sechs Carbonationen umgeben. Die Carbonationen sind in einem hexagonalen Muster um das Magnesiumion angeordnet. Die Kristallstruktur von MgCO3 ist eine wichtige Eigenschaft, da sie seine physikalischen und chemischen Eigenschaften bestimmt.
| Aussehen | Weißer Feststoff |
| Spezifische Dichte | 2.958 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 84,31 g/Mol |
| Dichte | 2.958 g/ml |
| Fusionspunkt | 990°C |
| Siedepunkt | Zersetzt sich vor Erreichen des Siedepunkts |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 0,02 g/L (15°C) |
| Löslichkeit | Löslich in Säuren, unlöslich in Wasser |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 10.3 |
| pH-Wert | 9.2-10.2 |
Sicherheit und Gefahren von Magnesiumcarbonat
MgCO3 gilt als sichere Verbindung. Es ist nicht brennbar, explosiv oder giftig. Allerdings muss damit wie mit jeder anderen chemischen Verbindung vorsichtig umgegangen werden. Das Einatmen von MgCO3-Staub kann zu Reizungen der Atemwege führen. Beim Umgang mit MgCO3 wird das Tragen geeigneter persönlicher Schutzausrüstung wie Handschuhe und Schutzbrille empfohlen. MgCO3 sollte an einem kühlen, trockenen Ort, entfernt von Wärme- und Zündquellen, gelagert werden. Verschüttetes MgCO3 muss sofort beseitigt und fachgerecht entsorgt werden. Es ist wichtig, beim Umgang mit MgCO3 die entsprechenden Sicherheitsvorkehrungen zu beachten, um mögliche Gefahren zu vermeiden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Nicht als gefährlich eingestuft |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2836.60.00 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität, stellt bei sachgemäßer Handhabung kein erhebliches Gesundheitsrisiko dar |
Methoden zur Magnesiumcarbonat-Synthese
Es gibt verschiedene Methoden zur Synthese von MgCO3, einschließlich Fällung und thermischer Zersetzung.
Um MgCO3 mithilfe der Fällungsmethode zu bilden, geben Sie ein lösliches Magnesiumsalz (z. B. Magnesiumchlorid oder Magnesiumnitrat) zu einer Lösung, die ein lösliches Carbonat (z. B. Natriumcarbonat oder Magnesiumnitrat) enthält. Ammoniumcarbonat). Dann rühren Sie die resultierende Mischung um und lassen Sie sie ruhen. Dadurch fällt das MgCO3 aus der Lösung aus. Danach den Niederschlag filtrieren, waschen und trocknen.
Um MgCO3 durch die thermische Zersetzungsmethode zu erhalten, wird Magnesiumhydroxid oder Magnesiumoxid unter Einleitung von Kohlendioxid erhitzt. Diese Reaktion führt zur Bildung von MgCO3 und Wasserdampf. Der nächste Schritt besteht darin, das MgCO3 zu sammeln, zu reinigen und zu trocknen.
Eine andere Methode zur Synthese von MgCO3 ist die Reaktion von Magnesiumsulfat und Natriumcarbonat . Wasser löst die beiden Verbindungen auf und vermischt sie dann, wodurch das MgCO3 aus der Lösung ausfällt. Anschließend wird der Niederschlag gesammelt, gewaschen und getrocknet.
Verwendung von Magnesiumcarbonat
MgCO3 ist eine vielseitige Verbindung mit vielfältigen Einsatzmöglichkeiten in verschiedenen Branchen. Hier sind einige seiner Verwendungsmöglichkeiten:
- Nahrungsergänzungsmittel: Wird aufgrund seiner Fähigkeit, den Körper mit essentiellem Magnesium zu versorgen, als Nahrungsergänzungsmittel verwendet.
- Antazidum: Wird als Antazidum zur Behandlung von Sodbrennen und Verdauungsstörungen verwendet.
- Industrielle Anwendungen: Wird in verschiedenen industriellen Anwendungen verwendet, beispielsweise bei der Herstellung von Keramik, Glas und Zement.
- Kosmetik: Wird in der Kosmetik als Quell-, Absorptions- und Trübungsmittel verwendet.
- Flammhemmend: Wird als Flammschutzmittel in verschiedenen Anwendungen verwendet, darunter Isoliermaterialien, Textilien und Kunststoffe.
- Pharmazeutika: Wird bei der Herstellung verschiedener pharmazeutischer Produkte wie Abführmittel und Antazida verwendet.
- Lebensmittelindustrie: Wird als Lebensmittelzusatzstoff zur Regulierung des Säuregehalts von Lebensmitteln und als Antibackmittel verwendet.
- Sportgeräte: Wird in Sportgeräten wie Turnkreide verwendet, um den Halt zu verbessern und ein Ausrutschen zu verhindern.
Fragen:
F: Ist Magnesiumcarbonat wasserlöslich?
A: MgCO3 hat eine geringe Wasserlöslichkeit. Bei Raumtemperatur können sich nur etwa 0,02 Gramm MgCO3 in 100 ml Wasser lösen.
F: Ist MgCO3 löslich?
A: MgCO3 hat eine geringe Wasserlöslichkeit, was bedeutet, dass es nicht sehr löslich ist.
F: Was entsteht, wenn Essigsäure und MgCO3 reagieren?
A: Wenn Essigsäure und MgCO3 reagieren, bilden sie Magnesiumacetat, Wasser und Kohlendioxid. Die ausgewogene chemische Gleichung für diese Reaktion lautet MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2.
F: Die molare Löslichkeit von MgCO3 beträgt 1,8 × 10–4 mol/L. Was ist Ksp für diese Verbindung?
A: Ksp-Wert für MgCO3 unter Verwendung der molaren Löslichkeit:
Ksp = [Mg2+][CO32-], wobei [Mg2+] gleich der molaren Löslichkeit ist und [CO32-] ebenfalls gleich der molaren Löslichkeit ist. Daher ist Ksp = (1,8 × 10–4 mol/L)2 = 3,24 × 10–9.
F: Welches der folgenden Produkte entsteht bei der Zersetzung von MgCO3?
A: Wenn sich MgCO3 zersetzt, entstehen Magnesiumoxid (MgO) und Kohlendioxid (CO2).
F: Wie lautet die ausgewogene chemische Gleichung für die Reaktion, die zur Berechnung von ΔH°f von MgCO3(s) verwendet wird?
A: Die ausgewogene chemische Gleichung der Reaktion, die zur Berechnung der Standardbildungsenthalpie (ΔH°f) von MgCO3(s) verwendet wird, lautet: Mg(s) + CO2(g) → MgCO3(s).
