Magnesiumbisulfit (Mg(HSO3)2) ist eine chemische Verbindung aus Magnesium, Schwefel und Sauerstoff. Es wird in der Lebensmittelindustrie häufig als Konservierungsmittel und Antioxidans verwendet, um Verderb und Verfärbung zu verhindern.
| IUPAC-Name | Magnesiumhydrogensulfit |
| Molekularformel | Mg(HSO3)2 |
| CAS-Nummer | 13774-25-9 |
| Synonyme | Magnesiumbisulfit; Magnesiumhydrogensulfit; Magnesiabisulfit |
| InChI | InChI=1S/2H2O3S.Mg/c2 1-4(2)3;/h2 (H2,1,2,3);/q;;+2/p-2 |
Eigenschaften von Magnesiumbisulfit
Magnesiumbisulfit-Formel
Die chemische Formel für Magnesiumbisulfit lautet Mg(HSO3)2. Die Formel stellt die Anzahl der Atome jedes Elements dar, die in einem Molekül der Verbindung vorhanden sind. Die Formel für Magnesiumbisulfit ist wichtig für die Bestimmung der chemischen Reaktionen, die die Verbindung eingehen kann.
Molmasse von Magnesiumbisulfit
Mg(HSO3)2 hat eine Molmasse von 186,45 g/mol. Dieser Wert gibt das Gewicht eines Mols der Verbindung in Gramm an. Die Molmasse einer Verbindung ist entscheidend dafür, wie viel von einer Substanz für die Durchführung chemischer Reaktionen benötigt wird. Die Molmasse von Mg(HSO3)2 wird durch Addition der Atomgewichte jedes Elements in der Verbindung berechnet. Magnesium hat ein Atomgewicht von 24,305 g/mol, Schwefel hat ein Atomgewicht von 32,06 g/mol und Sauerstoff hat ein Atomgewicht von 15,999 g/mol.
Siedepunkt von Magnesiumbisulfit
Mg(HSO3)2 hat keinen Siedepunkt, da es sich beim Erhitzen zersetzt. Allerdings kann es beim Erhitzen in Gegenwart einer Säure Schwefeldioxid und Schwefeltrioxid freisetzen. Diese Gase können die Atemwege reizen und beim Einatmen schwerwiegende Gesundheitsschäden verursachen. Daher ist es wichtig, mit Mg(HSO3)2 sorgfältig umzugehen und Sicherheitsvorkehrungen zu beachten, wenn es in industriellen Prozessen verwendet wird.
Schmelzpunkt von Magnesiumbisulfit
Mg(HSO3)2 hat einen Schmelzpunkt von 110°C. Dieser Wert stellt die Temperatur dar, bei der die Verbindung vom festen in den flüssigen Zustand übergeht. Mg(HSO3)2 hat einen niedrigen Schmelzpunkt, wodurch es leicht zu schmelzen und in verschiedenen industriellen Prozessen zu verwenden ist. Allerdings kann es sich bei hohen Temperaturen zersetzen, wodurch schädliche Gase freigesetzt werden.
Dichte von Magnesiumbisulfit g/ml
Mg(HSO3)2 hat eine Dichte von 2,35 g/ml. Dieser Wert stellt die Massenmenge in Gramm dar, die in einem Milliliter der Verbindung vorhanden ist. Die Dichte von Mg(HSO3)2 ist größer als die von Wasser, das eine Dichte von 1 g/ml hat. Die hohe Dichte von Mg(HSO3)2 macht es für verschiedene Anwendungen nützlich, unter anderem als Konservierungsmittel und Antioxidans in der Lebensmittelindustrie.
Molekulargewicht von Magnesiumbisulfit
Mg(HSO3)2 hat ein Molekulargewicht von 186,45 g/mol. Dieser Wert stellt die Summe der Atomgewichte aller Atome in der Verbindung dar. Das Molekulargewicht von Mg(HSO3)2 ist entscheidend für die Bestimmung der Menge der Verbindung, die zur Durchführung chemischer Reaktionen benötigt wird.
Struktur von Magnesiumbisulfit
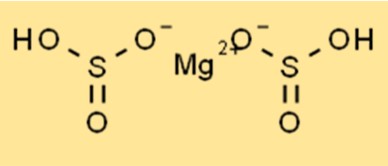
Mg(HSO3)2 hat eine Kristallstruktur und gehört zum orthorhombischen Kristallsystem. Die Verbindung besteht aus Magnesiumkationen (Mg2+) und Bisulfit-Anionen (HSO3-). Bisulfit-Anionen haben eine tetraedrische Form, während Magnesiumkationen eine oktaedrische Form haben. Die Kristallstruktur von Mg(HSO3)2 macht es stabil und ermöglicht die Verwendung in verschiedenen Anwendungen, unter anderem als Lebensmittelkonservierungsmittel.
Löslichkeit von Magnesiumbisulfit
Mg(HSO3)2 ist in Wasser gut löslich, mit einer Löslichkeit von etwa 64 g/100 ml bei 20 °C. Es ist auch in Methanol löslich, in den meisten organischen Lösungsmitteln jedoch unlöslich. Die Löslichkeit von Mg(HSO3)2 kann je nach Faktoren wie Temperatur und pH-Wert variieren.
| Aussehen | weißes Puder |
| Spezifisches Gewicht | 2,35 g/cm3 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 186,45 g/Mol |
| Dichte | 2,35 g/ml |
| Fusionspunkt | 110°C |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser und Ethanol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 1,91 |
| pH-Wert | 4,5 – 5,5 |
Sicherheit und Gefahren von Magnesiumbisulfit
Mg(HSO3)2 kann bei unsachgemäßer Handhabung mehrere Gesundheits- und Sicherheitsrisiken bergen. Es kann Schwefeldioxid- und Schwefeltrioxidgase freisetzen, wenn es erhitzt oder sauren Bedingungen ausgesetzt wird. Diese Gase können beim Einatmen Reizungen der Atemwege, Husten und Kurzatmigkeit verursachen. Mg(HSO3)2 kann bei Kontakt auch Hautreizungen und Rötungen verursachen. Beim Umgang mit Mg(HSO3)2 ist das Tragen von Schutzkleidung und -ausrüstung wie Handschuhen und Schutzbrillen unbedingt erforderlich. Darüber hinaus sollte es an einem kühlen, trockenen Ort, entfernt von Wärmequellen und inkompatiblen Materialien, gelagert werden. Durch ordnungsgemäße Handhabungs- und Lagerungsverfahren kann das mit Mg(HSO3)2 verbundene Risiko minimiert werden.
| Gefahrensymbole | Xi: Irritierend |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Tragen Sie Schutzkleidung und -ausrüstung. Von Hitze und unverträglichen Materialien fernhalten. |
| UN-Identifikationsnummern | UN 2693 |
| HS-Code | 2831.10.00 |
| Gefahrenklasse | 8 – Ätzende Stoffe |
| Verpackungsgruppe | III |
| Toxizität | Kann Haut- und Augenreizungen verursachen. Gesundheitsschädlich beim Einatmen oder Verschlucken. Kann Reizungen der Atemwege und Husten verursachen. |
Synthesemethoden für Magnesiumbisulfit
Mg(HSO3)2 kann mit verschiedenen Methoden synthetisiert werden, darunter:
- Reaktion von Magnesiumhydroxid mit Schwefeldioxid: Bei der Reaktion von Magnesiumhydroxid mit Schwefeldioxid reagieren die beiden Stoffe zu Mg(HSO3)2 und Wasser.
- Direkte Reaktion von Magnesiumoxid mit Schwefeldioxid: Bei hohen Temperaturen reagiert Schwefeldioxidgas direkt mit Magnesiumoxid unter Bildung von Mg(HSO3)2 und Sauerstoff.
- Reaktion von Magnesiumsulfat mit Schwefeldioxid: In Gegenwart eines Reduktionsmittels reagiert Magnesiumsulfat mit Schwefeldioxidgas, was zur Bildung von Mg(HSO3)2 führt.
- Magnesiumcarbonat mit Schwefeldioxid: Die Reaktion zwischen Magnesiumcarbonat und Schwefeldioxidgas erzeugt Mg(HSO3)2 und Kohlendioxid.
- Reaktion von Magnesiumoxid mit Schwefelsäure und Schwefeldioxid: Bei der Reaktion von Magnesiumoxid mit Schwefelsäure und Schwefeldioxidgas entstehen Mg(HSO3)2 und Wasser.
Verwendung von Magnesiumbisulfit
Mg(HSO3)2 wird in unterschiedlichen Branchen vielfältig eingesetzt. Hier sind einige häufige Anwendungen:
- Lebensmittel- und Getränkeindustrie: Wird in der Lebensmittel- und Getränkeindustrie als Konservierungsmittel verwendet, um Oxidation und mikrobielles Wachstum zu verhindern. Es wird häufig in Fruchtsäften, Wein und Bier verwendet.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung als Reduktionsmittel zur Entfernung von Chlor und anderen Oxidationsmitteln verwendet. Es ist wirksam bei der Kontrolle des Geruchs und Geschmacks von Wasser.
- Textilindustrie: Wird als Bleichmittel in der Textilindustrie verwendet. Es entfernt wirksam Flecken und verbessert die Farbe von Stoffen.
- Pharmazeutische Industrie: Wird als Reduktionsmittel in der pharmazeutischen Industrie verwendet. Es wird verwendet, um Nitrogruppen in verschiedenen Arzneimittelmolekülen in Aminogruppen umzuwandeln.
- Zellstoff- und Papierindustrie: Wird in der Zellstoff- und Papierindustrie als Bleichmittel verwendet. Es entfernt wirksam Lignin aus Zellstoff und verbessert den Papierglanz.
- Landwirtschaft: Wird in der Landwirtschaft als Bodenverbesserungsmittel zur Korrektur von Magnesiummangel im Boden verwendet. Es wird auch als Blattdünger verwendet, um das Pflanzenwachstum und den Ertrag zu verbessern.
Fragen:
F: Was sind die thermodynamischen Eigenschaften von Magnesiumbisulfit?
A: Zu den thermodynamischen Eigenschaften von Mg(HSO3)2 gehören sein Siedepunkt von 250 °C, sein Schmelzpunkt von 70–72 °C und seine Dichte von 1,84 g/ml.
F: Wie lautet die chemische Formel von Magnesiumbisulfit?
A: Die chemische Formel für Magnesiumbisulfit lautet Mg(HSO3)2.
F: Wo kann ich Magnesiumbisulfit kaufen?
A: Mg(HSO3)2 kann von verschiedenen Chemikalienlieferanten und -händlern erworben werden. Es ist allgemein in großen und kleinen Mengen erhältlich. Einige Online-Plattformen wie Sigma Aldrich, Fisher Scientific und VWR International bieten auch Mg(HSO3)2 zum Kauf an. Es ist wichtig sicherzustellen, dass der Lieferant seriös ist und das Produkt den für die beabsichtigte Anwendung erforderlichen Standards entspricht.
