Magnesiumacetat (Mg(C2H3O2)2) ist eine Verbindung bestehend aus Mg2+- und C2H3O2–Ionen. Es wird häufig als Trocknungsmittel in der organischen Synthese und als Lebensmittelzusatzstoff verwendet.
| IUPAC-Name | Magnesiumacetat |
| Molekularformel | Mg(C2H3O2)2 |
| CAS-Nummer | 142-72-3 |
| Synonyme | Magnesiumdiacetat, Magnesiumsalz der Essigsäure, Magnesiumethanoat, CAS 73567-85-6, EINECS 240-882-6, UNII-RS92S4G29A |
| InChI | InChI=1S/2C2H4O2.Mg/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschaften von Magnesiumacetat
Magnesiumacetat-Formel
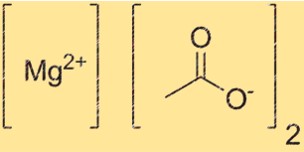
Die chemische Formel für Magnesiumacetat lautet Mg(C2H3O2)2. Diese Formel stellt die Zusammensetzung der Verbindung dar, mit einem Mg2+-Ion und zwei C2H3O2-. Die Formel ist wichtig, um die Menge der Verbindung zu bestimmen, die für eine bestimmte Reaktion benötigt wird. Es ist auch nützlich, um die Verbindung in verschiedenen Kontexten zu identifizieren.
Molmasse von Magnesiumacetat
Die Molmasse von Mg(C2H3O2)2 beträgt 142,39 g/mol. Dieser Wert ergibt sich durch Addition der Atommassen der Mg2+- (24,31 g/mol) und C2H3O2- (58,08 g/mol)-Ionen. Die Molmasse ist eine wichtige Eigenschaft bei der Bestimmung der Menge an Mg(C2H3O2)2, die für eine bestimmte Reaktion benötigt wird.
Siedepunkt von Magnesiumacetat
Mg(C2H3O2)2 hat einen relativ hohen Siedepunkt von 117,5 °C (243,5 °F). Diese Eigenschaft ist auf die ionische Natur der Verbindung und die starke elektrostatische Anziehung zwischen den Magnesium- und Acetationen zurückzuführen. Bei dieser Temperatur beginnt die Verbindung zu verdampfen, bleibt jedoch im flüssigen Zustand, sofern sie keinen höheren Temperaturen ausgesetzt wird.
Magnesiumacetat Schmelzpunkt
Der Schmelzpunkt von Mg(C2H3O2)2 beträgt 160 °C (320 °F). Dieser Wert wird ermittelt, indem die Verbindung erhitzt wird, bis sie vom Feststoff in den flüssigen Zustand übergeht. Der Schmelzpunkt ist eine wichtige Eigenschaft, die die Temperatur bestimmt, bei der die Verbindung vom festen in den flüssigen Zustand übergeht. Diese Eigenschaft ist für die ordnungsgemäße Handhabung und Lagerung des Compounds von wesentlicher Bedeutung.
Dichte von Magnesiumacetat g/ml
Die Dichte von Mg(C2H3O2)2 beträgt 1,45 g/ml. Dieser Wert wird ermittelt, indem man die Masse der Verbindung durch ihr Volumen dividiert. Die Dichte ist eine wichtige Eigenschaft, die die Masse eines bestimmten Volumens der Verbindung bestimmt. Es ist auch eine nützliche Eigenschaft zur Bestimmung der Reinheit der Verbindung, da Verunreinigungen die Dichte beeinflussen können.
Molekulargewicht von Magnesiumacetat
Das Molekulargewicht von Mg(C2H3O2)2 beträgt 142,39 g/mol. Dieser Wert ergibt sich durch Addition der Atommassen von Magnesium und zwei Acetationen. Das Molekulargewicht ist eine wichtige Eigenschaft, die die Menge einer Verbindung bestimmt, die für eine bestimmte Reaktion benötigt wird. Es ist auch nützlich, um die Reinheit der Verbindung zu bestimmen.
Struktur von Magnesiumacetat
Mg(C2H3O2)2 hat eine ionische Struktur, in der die Mg2+-Kationen von zwei C2H3O2-Anionen umgeben sind. Das Mg2+-Kation hat eine Ladung von +2, während das C2H3O2–Anion eine Ladung von -1 hat. Die Struktur wird durch elektrostatische Anziehung zwischen entgegengesetzt geladenen Ionen zusammengehalten.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 1,45 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 142,39 g/Mol |
| Dichte | 1,45 g/ml |
| Fusionspunkt | 160 °C (320 °F) |
| Siedepunkt | 117,5 °C (243,5 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Ethanol, Methanol, Aceton |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | 4,76 |
| pH-Wert | 7,5 – 9,0 |
Sicherheit und Gefahren von Magnesiumacetat
Mg(C2H3O2)2 gilt im Allgemeinen als sicher für die Verwendung in den beabsichtigten Anwendungen, aber wie bei jeder chemischen Verbindung gibt es einige potenzielle Gefahren, die man beachten sollte. Beim Einatmen oder Verschlucken kann es zu Reizungen der Haut, der Augen und der Atemwege kommen. Eine längere oder wiederholte Exposition kann schwerwiegendere gesundheitliche Auswirkungen haben. Mg(C2H3O2)2 sollte mit Vorsicht gehandhabt werden und beim Umgang mit dieser Verbindung sollten entsprechende Schutzmaßnahmen getroffen werden. Es ist außerdem wichtig, ordnungsgemäße Lagerungs- und Entsorgungsprotokolle einzuhalten, um versehentliche Exposition oder Umweltschäden zu vermeiden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | S22 – Staub nicht einatmen; S24/25 – Kontakt mit Haut und Augen vermeiden; S36/37/39 – Tragen Sie geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz; S45 – Bei einem Unfall oder Unwohlsein sofort einen Arzt aufsuchen (wenn möglich, diesem das Etikett vorzeigen) |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 29152900 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität, kann jedoch bei unsachgemäßer Handhabung Haut, Augen und Atemwege reizen |
Synthesemethoden für Magnesiumacetat
Synthetisieren Sie Mg(C2H3O2)2 mit verschiedenen Methoden, einschließlich der Reaktion von Magnesiumoxid oder Magnesiumhydroxid mit Essigsäure .
Bei einer gängigen Methode wird Magnesiumoxid zu einer Essigsäurelösung gegeben, um Mg(C2H3O2)2 und Wasser zu bilden. Filtrieren Sie die resultierende Lösung und verdampfen Sie sie, um ein festes Produkt Mg(C2H3O2)2 zu erhalten.
Eine andere Methode beinhaltet die Reaktion von Magnesiummetall mit Essigsäure in Gegenwart eines Katalysators wie Kupferchlorid oder Kupfersulfat. Bei der Reaktion entstehen Mg(C2H3O2)2, Wasserstoffgas und metallisches Kupfer als Nebenprodukt.
Synthetisieren Sie Mg(C2H3O2)2 durch eine Metathesereaktion, indem Sie Magnesiumchlorid mit Natriumacetat in Gegenwart von Wasser reagieren lassen, um Mg(C2H3O2)2 und Natriumchlorid zu erzeugen.
Insgesamt hängt die Wahl der Synthesemethode von Faktoren wie der gewünschten Reinheit des Mg(C2H3O2)2-Produkts, der Verfügbarkeit von Rohstoffen und dem Umfang des Produktionsprozesses ab.
Verwendung von Magnesiumacetat
Mg(C2H3O2)2 hat aufgrund seiner einzigartigen Eigenschaften ein breites Anwendungsspektrum in verschiedenen Branchen. Hier sind einige häufige Verwendungen von Mg(C2H3O2)2:
- Lebensmittelzusatzstoffe: Werden als Lebensmittelzusatzstoffe verwendet, um den Nährwert von Lebensmitteln zu verbessern und deren Verderb zu verhindern.
- Medizin: Wird medizinisch als Magnesiumquelle verwendet, einem essentiellen Mineralstoff, der bei vielen physiologischen Prozessen eine Schlüsselrolle spielt.
- Textilien: Wird in der Textilindustrie als Beizmittel verwendet, eine Substanz, die dabei hilft, Farbstoffe auf Stoffen zu fixieren.
- Wasseraufbereitung: Wird in Wasseraufbereitungsanwendungen verwendet, um Verunreinigungen aus dem Wasser zu entfernen und Kalkablagerungen in Rohren und Geräten zu verhindern.
- Beton: Wird bei der Herstellung von Beton verwendet, um dessen Festigkeit und Haltbarkeit zu verbessern.
- Chemische Synthese: Wird als Rohstoff für die Synthese anderer chemischer Verbindungen wie Arzneimittel, Aromen und Parfüme verwendet.
Fragen:
F: Was entsteht, wenn Essigsäure und Magnesiumcarbonat reagieren?
A: Wenn Essigsäure und Magnesiumcarbonat reagieren, entstehen Mg(C2H3O2)2, Kohlendioxid und Wasser.
F: Wo kann man Calciummagnesiumacetat kaufen?
A: Calcium Mg(C2H3O2)2 kann bei verschiedenen Chemikalienlieferanten und Online-Marktplätzen erworben werden.
F: Ist Magnesiumacetat wasserlöslich?
A: Ja, Mg(C2H3O2)2 ist in Wasser löslich, mit einer Löslichkeit von etwa 54 g/L bei Raumtemperatur.
F: Wie hoch ist die molare Konzentration einer 5,00-l-Lösung, die 0,800 Mol Magnesiumacetat enthält?
A: Die molare Konzentration einer 5,00-l-Lösung mit 0,800 Mol Mg(C2H3O2)2 beträgt 0,160 M.
